
Wetenschap
Waarom waterstof in koolwaterstoffen bindingen maken?
* Elektronenconfiguratie: Waterstof heeft slechts één proton en één elektron. Het heeft twee elektronen nodig om zijn buitenste schaal te vullen en een stabiele configuratie zoals helium te bereiken.
* Covalente binding: Waterstof bereikt deze stabiliteit door zijn enkele elektron te delen met een ander atoom, meestal koolstof in koolwaterstoffen. Dit gedeelde paar elektronen vormt een covalente binding.
* Koolstofverbindingscapaciteit: Koolstof, met vier valentie -elektronen, heeft nog vier elektronen nodig om een stabiel octet te bereiken. Het kan vier covalente bindingen vormen met waterstof of andere koolstofatomen.
In koolwaterstoffen vormen waterstof- en koolstofatomen sterke covalente bindingen:
* Sterke aantrekkingskracht: De gedeelde elektronen tussen waterstof en koolstof worden aangetrokken door beide kernen, waardoor een sterke binding ontstaat.
* stabiliteit: De covalente bindingen geven zowel waterstof als koolstof een stabiele elektronenconfiguratie, waardoor het koolwaterstofmolecuul stabiel is.
Voorbeeld: Methaan (CH4)
In methaan deelt het koolstofatoom zijn vier valentie-elektronen met vier waterstofatomen, waardoor vier C-H covalente bindingen worden gevormd. Elk waterstofatoom bereikt zijn stabiele duet en het koolstofatoom bereikt zijn stabiele octet.
In wezen vormt waterstof bindingen in koolwaterstoffen omdat het stabiel wil zijn en door elektronen met koolstof te delen, bereikt het een stabiele configuratie. Dit proces creëert sterke en stabiele koolwaterstofmoleculen.
 Nucleon is elektrisch neutraal, het wordt genoemd?
Nucleon is elektrisch neutraal, het wordt genoemd?  Onoplosbare sulfideverbindingen zijn over het algemeen zwart van kleur Welke van de volgende combinaties kan een neerslag opleveren?
Onoplosbare sulfideverbindingen zijn over het algemeen zwart van kleur Welke van de volgende combinaties kan een neerslag opleveren?  Waarom zouden chemici de omstandigheden aanpassen om de voorwaartse reactie in een proces te bevorderen?
Waarom zouden chemici de omstandigheden aanpassen om de voorwaartse reactie in een proces te bevorderen?  Hoeveel elektronen zijn er op elke baan voor natrium?
Hoeveel elektronen zijn er op elke baan voor natrium?  Chili-vormig apparaat zou kunnen onthullen hoe heet die peper is
Chili-vormig apparaat zou kunnen onthullen hoe heet die peper is
Hoofdlijnen
- Zijn 'hondenjaren' echt? Een uitleg over het berekenen van de leeftijd van honden
- Hoe epigenetica werkt
- Wat zijn de namen van verschillende soorten algen?
- Wetenschappers onthullen hoe RNA correct wordt gesplitst
- Meest voorkomende modificatie in genstructuur het menselijke genoom?
- Hoe zouden vacuolen in planten dienen als verdediging tegen die opeten?
- Wat is een ecologisch model van de relaties die netwerkcomplexe interacties vormen tussen organismen in gemeenschap van producenten tot ontleders?
- Wat zijn de enkelvoudige zelfstandige naamwoorden van schimmels?
- Waar komen bloedcellen vandaan?
- True to type:van menselijke biopsie tot complexe darmfysiologie op een chip
- Enzym-actiefilm laat zien hoe de natuur penicillines maakt

- Chemicus stelt zweetanalyse voor om elektronica beter te beveiligen
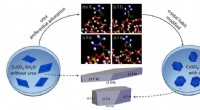
- Het effect van ureumadditieven op de fysisch-chemische eigenschappen van kristallen
- Goedkope hernieuwbare energie:het fotosyntheseproces doorbreken dat planten in staat stelt om wat te splitsen

 Welke twee gebeurtenissen moeten plaatsvinden voor een totale zonsverduistering?
Welke twee gebeurtenissen moeten plaatsvinden voor een totale zonsverduistering?  Een nieuwe studie heeft geconcludeerd dat er geen duidelijk bewijs is dat COVID-19 werd overgedragen door vleermuizen
Een nieuwe studie heeft geconcludeerd dat er geen duidelijk bewijs is dat COVID-19 werd overgedragen door vleermuizen Wat voor soort energie is bezeten door regendruppels als ze gewoon op de grond vallen?
Wat voor soort energie is bezeten door regendruppels als ze gewoon op de grond vallen?  NASA herstart rigoureuze trillingstests op de James Webb Space Telescope
NASA herstart rigoureuze trillingstests op de James Webb Space Telescope Wie is groener? Mijngevecht zet elektrische auto's tegenover bloem
Wie is groener? Mijngevecht zet elektrische auto's tegenover bloem  Hoe maak je een 3-D Bohr Model
Hoe maak je een 3-D Bohr Model  Welke massieve ster is het minst massief?
Welke massieve ster is het minst massief?  's Werelds eerste professionele acrobaten vlogen door het Midden-Oosten 4, 000 jaar geleden
's Werelds eerste professionele acrobaten vlogen door het Midden-Oosten 4, 000 jaar geleden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

