
Wetenschap
Zijn de atomen van natriumchloride bij elkaar gehouden door ionische bindingen?
* natrium (na) is een metaal en heeft de neiging om één elektron te verliezen om een positief geladen ion (Na+) te worden.
* chloor (Cl) is een niet-metaal en heeft de neiging om één elektron te krijgen om een negatief geladen ion te worden (Cl-).
* Elektrostatische aantrekkingskracht: De tegengesteld geladen ionen (Na+ en Cl-) worden sterk tot elkaar aangetrokken vanwege elektrostatische krachten, waardoor een ionische binding wordt gevormd.
Deze sterke elektrostatische aantrekkingskracht tussen de ionen geeft ionische verbindingen zoals natriumchloride hun karakteristieke eigenschappen, zoals:
* Hoog smelten- en kookpunten: De sterke ionische bindingen vereisen veel energie om te breken.
* Oplosbaarheid in water: Watermoleculen kunnen de ionen omringen en scheiden, waardoor de verbinding oplost.
* geleidbaarheid in de gesmolten of opgeloste toestand: De vrij bewegende ionen kunnen elektrische stroom dragen.
 Hoe te bepalen of er een reactie was in een chemische vergelijking
Hoe te bepalen of er een reactie was in een chemische vergelijking  In bepaalde omstandigheden zijn de evenwichtsconcentraties voor componenten in reactie 2nocl g no (g) plus CL2 (g) geen 0,02 m Cl2 0,01 en NOCL 0.H m. wat is waarde keq gegeven no2cl2 nocl2?
In bepaalde omstandigheden zijn de evenwichtsconcentraties voor componenten in reactie 2nocl g no (g) plus CL2 (g) geen 0,02 m Cl2 0,01 en NOCL 0.H m. wat is waarde keq gegeven no2cl2 nocl2?  Wat is de oplosbaarheid van zilvernitraat als slechts 11,1 g kan oplossen in 5,0 water bij 20 ° C?
Wat is de oplosbaarheid van zilvernitraat als slechts 11,1 g kan oplossen in 5,0 water bij 20 ° C?  Wat is een voorbeeld van een compound?
Wat is een voorbeeld van een compound?  Wat is de formule voor zout die gevormd is wanneer zoutzuur reageert met natriumhydroxide?
Wat is de formule voor zout die gevormd is wanneer zoutzuur reageert met natriumhydroxide?
 Stabiele fase van ecologische diversiteit en balans wordt hoe genoemd?
Stabiele fase van ecologische diversiteit en balans wordt hoe genoemd?  'Threat multiplier':hoe klimaatverandering de gezondheid beïnvloedt
'Threat multiplier':hoe klimaatverandering de gezondheid beïnvloedt  De autowetgeving in Japan heeft de luchtkwaliteit verbeterd
De autowetgeving in Japan heeft de luchtkwaliteit verbeterd Kan herbegroeiing de bodem van de fotovoltaïsche zonne-energie in zijn ongerepte glorie herstellen?
Kan herbegroeiing de bodem van de fotovoltaïsche zonne-energie in zijn ongerepte glorie herstellen? Methaanuitstoot VS stabiel sinds 2006 ondanks toegenomen olie- en gasactiviteit
Methaanuitstoot VS stabiel sinds 2006 ondanks toegenomen olie- en gasactiviteit
Hoofdlijnen
- Welke moleculen fungeren als energieopslagmolecuul in de spieren door fosfor te doneren om ATP en ADP opnieuw te synthetiseren?
- Welke religie volgde Charles Darwin?
- Hoe een vormveranderende DNA-reparatiemachine kanker bestrijdt
- Genetici lossen een veertig jaar oud dilemma op om te verklaren waarom dubbele genen in het genoom achterblijven
- Hoe worden niet -schadelijke bacteriën genoemd?
- Welk type levenscyclus bestaat er waarin de haploïde vorm altijd als mensen eencellig is?
- Welke planten zijn niet in staat om zichzelf te bestuiven?
- Ongeveer welk percentage van een genen op elk moment wordt gebruikt a. 1 tot 2 procent b. 5 10 c. 25 50 procent. D. 70 80 e. 90 99 percen?
- Is een enzym een biochemisch molecuul dat door de meeste organismen wordt gebruikt?
- Ontwikkeling van een nieuwe eindfunctionalisatietechniek in polymeersynthese
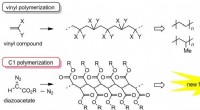
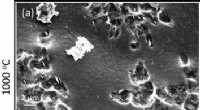
- Onderzoekers fabriceren van polyacrylonitril afgeleide koolstoffilms en vezels bij hoge temperatuur
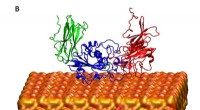
- XSEDE-supercomputertoewijzingen op Stampede1 en Comet helpen bij het vouwen van eiwitten in onderzoek naar botregeneratie
- Nieuw polymeermateriaal kan ervoor zorgen dat batterijen zelfherstellend worden, recyclebaar

- Onzichtbaar, rekbare circuits om de volgende generatie technologie vorm te geven

 Chandra hervat wetenschappelijke operaties
Chandra hervat wetenschappelijke operaties Eerste resultaat van verbeterde CEBAF opent deur naar onderzoek naar universele lijm
Eerste resultaat van verbeterde CEBAF opent deur naar onderzoek naar universele lijm Kan koolmonoxide afkomstig zijn van radiatoren?
Kan koolmonoxide afkomstig zijn van radiatoren?  Beschrijving van Plate Tectonics & How It Explains the Distribution of Tectonic Activity
Beschrijving van Plate Tectonics & How It Explains the Distribution of Tectonic Activity  Wat betekenen terres inconnectief?
Wat betekenen terres inconnectief?  De tolerantie van Amerikanen voor racistische uitingen neemt af
De tolerantie van Amerikanen voor racistische uitingen neemt af Welke van de volgende vermeldt ingrediënten Solar Nebula van de hoogste tot laagste percentage massa -nevel?
Welke van de volgende vermeldt ingrediënten Solar Nebula van de hoogste tot laagste percentage massa -nevel?  Nano-elektroden registreren duizenden verbonden zoogdierneuronen van binnenuit
Nano-elektroden registreren duizenden verbonden zoogdierneuronen van binnenuit
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

