
Wetenschap
Wat is de moleculaire vorm van ALCL6?
Alcl6 is een octaëdral molecuul.
Dit is waarom:
* aluminium (AL) heeft drie valentie -elektronen.
* chloor (Cl) heeft zeven valentie -elektronen.
* In ALCL6 is aluminium gebonden aan zes chlooratomen. Dit betekent dat het aluminiumatoom zes bindingsparen van elektronen en geen eenzame paren heeft.
Volgens de VSEPR (Valent Shell Electron Pair -afstoting) theorie zullen zes bindingsparen rond een centraal atoom zich in een octaëdrische vorm regelen om elektronenafstoting te minimaliseren.
Daarom heeft ALCL6 een octaëdrische moleculaire vorm.
 Hoe snel kunnen bosbranden zich verspreiden?
Hoe snel kunnen bosbranden zich verspreiden?  Wetenschappers bestuderen hoe de met uitsterven bedreigde Bairds tapir en boeren in Nicaragua naast elkaar kunnen bestaan
Wetenschappers bestuderen hoe de met uitsterven bedreigde Bairds tapir en boeren in Nicaragua naast elkaar kunnen bestaan  Het dodelijke probleem van kolenas
Het dodelijke probleem van kolenas  Oceaantemperatuur als een vitaal teken dat de opwarming van de aarde onthult
Oceaantemperatuur als een vitaal teken dat de opwarming van de aarde onthult NASA vindt tropische depressie Yutu aan het vervagen voor de kust van China
NASA vindt tropische depressie Yutu aan het vervagen voor de kust van China
Hoofdlijnen
- Hoe oude moa de ijstijd heeft overleefd en wat ze ons kunnen leren over moderne klimaatverandering
- Wie patenteert wiens genoom?
- Hoe genenbanken werken
- Snurken of zweven? De sterkte van het immuunsysteem van fruitvliegjes varieert
- Scheepslawaai beïnvloedt het vermogen van mariene soorten om te communiceren
- Wat wordt gemaakt door organisme met de genotype TTSS?
- Welke chromosomen slaan het erfelijke materiaal op?
- Cellen produceren ATP het meest efficiënt in aanwezigheid van welk molecuul?
- Wanneer de concentratie hoger is op buiten de cel, is het?
- Damp drijft een vloeistof-vaste overgang in een moleculair systeem aan
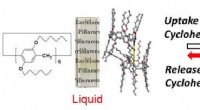
- Wat hangt er in de lucht? Er komt meer bij kijken dan we dachten
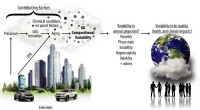
- Sneller kooldioxide afbreken, goedkoper, en efficiënter
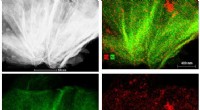
- Antibioticaresistentie verlichten:onderzoekers zetten stappen in de richting van een nieuwe behandeling voor E. coli

- Origami en kirigami gebruiken om herconfigureerbare maar structurele materialen te inspireren

 Wat zijn de belangrijkste sterren van Melkweg?
Wat zijn de belangrijkste sterren van Melkweg?  Waar zou je kunnen verwachten vulkanen te vinden?
Waar zou je kunnen verwachten vulkanen te vinden?  Levenscyclus van een adelaar
Levenscyclus van een adelaar  Wachten op de volledige breuk
Wachten op de volledige breuk Mensen zijn goed in het bedenken van problemen, maar klimaatverandering is ons te slim af
Mensen zijn goed in het bedenken van problemen, maar klimaatverandering is ons te slim af Opinie:Nobelprijswinnende economie van klimaatverandering is misleidend en gevaarlijk, en hier is waarom
Opinie:Nobelprijswinnende economie van klimaatverandering is misleidend en gevaarlijk, en hier is waarom Studie biedt vroegste bewijs dat mensen ecosystemen veranderen met vuur
Studie biedt vroegste bewijs dat mensen ecosystemen veranderen met vuur Deze bruine dwerg is geen mislukte ster - het is een magnetische krachtpatser
Deze bruine dwerg is geen mislukte ster - het is een magnetische krachtpatser
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

