
Wetenschap
Stel dat twee gassen in een container een totale druk van 1,20Atm hebben Wat is de gas B als gedeeltelijk A 0.75ATM is?
Dalton's wet van gedeeltelijke druk
De wet van Dalton stelt dat de totale druk van een mengsel van gassen gelijk is aan de som van de gedeeltelijke druk van de afzonderlijke gassen.
formule
P totaal =P a + P b + P c + ...
waar:
* P totaal is de totale druk van het gasmengsel
* P a , P b , P c , ... zijn de gedeeltelijke druk van elk individueel gas
De wet toepassen op het probleem
1. We weten:
* P totaal =1,20 atm
* P a =0,75 atm
2. We willen vinden:
* P B
3. met behulp van de wet van Dalton:
1,20 atm =0,75 atm + p b
4. Oplossen voor P B :
P b =1,20 atm - 0,75 atm
P b =0,45 atm
Daarom is de gedeeltelijke druk van gas B 0,45 atm.
Hoofdlijnen
- Van één cel naar vele:hoe is meercelligheid geëvolueerd?
- Grote organen van de systemen in het lichaam?
- Grootte van witrotschimmels verklaard door de breedte van de betrokken genfamilies
- Wat maakt DNA -replicatie?
- Enzym-actiefilm laat zien hoe de natuur penicillines maakt
- Waarom is de interpretatie van het resultaat belangrijk in de wetenschap?
- Wanneer twee cellen met N -aantal chromosomen fuseren, welk type cel resulteren?
- Wat is een wetenschappelijk rapport?
- Hoeveel cellen hebben levende wezens?
- Synthese van tetrafenylammonium:bevestiging van het bestaan van het fantoomion
- Gebruik van geradicaliseerde NOₓ-derivaten op metaaloxiden

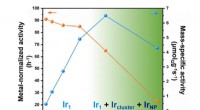
- Een op ruthenium gebaseerde katalysator met zeer actieve, vlakke oppervlakken presteren beter dan op metaal gebaseerde concurrenten
- Hoe beïnvloeden stromingskrachten van geladen oppervlakken/deeltjes en oppervlakteactieve stoffen in vloeistoffen?

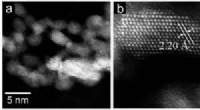
- Hoogbelastende atomair gedispergeerde Ir/MoC-katalysator voor hydrogeneringsreactie
 Welke twee stoffen die ervoor zorgen dat metalen sneller roesten?
Welke twee stoffen die ervoor zorgen dat metalen sneller roesten?  Wat is er slecht aan zonne -energie?
Wat is er slecht aan zonne -energie?  Seven Stages of Early Man
Seven Stages of Early Man  Niet zo met arendsogen:nieuw onderzoek onthult waarom vogels botsen met door de mens gemaakte objecten
Niet zo met arendsogen:nieuw onderzoek onthult waarom vogels botsen met door de mens gemaakte objecten  Hoeveel metaalatomen zijn er in Al2S3?
Hoeveel metaalatomen zijn er in Al2S3?  Nieuw onderzoek laat zien hoe ziekteverwekkende parasieten de menselijke aangeboren immuniteit omzeilen
Nieuw onderzoek laat zien hoe ziekteverwekkende parasieten de menselijke aangeboren immuniteit omzeilen  Is een magnetische kracht een contactloze kracht?
Is een magnetische kracht een contactloze kracht?  Wanneer golven de kustlijn slaan, concentreren ze hun energie op?
Wanneer golven de kustlijn slaan, concentreren ze hun energie op?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


