
Wetenschap
Waarom oplossen NaCl meer in water dan jodium?
Inzicht in oplosbaarheid
* Polar vs. Nonpolar: Oplosbaarheid hangt af van het principe "Like Lost Like". Polaire stoffen (zoals water) lossen goed op in andere polaire stoffen, en niet -polaire stoffen (zoals olie) lost goed op in andere niet -polaire stoffen.
* ionische verbindingen: Ionische verbindingen zoals NaCl worden gevormd door de elektrostatische aantrekkingskracht tussen positief geladen ionen (kationen) en negatief geladen ionen (anionen).
Waarom NaCl goed oplost in water
1. waterpolariteit: Watermoleculen zijn polair, wat betekent dat ze een enigszins positief uiteinde hebben (waterstofzijde) en een enigszins negatief uiteinde (zuurstofzijde). Deze polariteit stelt hen in staat om te communiceren met de ionen in NaCl.
2. ionische interacties: Wanneer NaCl wordt toegevoegd aan water, trekt het positieve uiteinde van watermoleculen de negatieve chloride-ionen (Cl-) aan en trekt het negatieve uiteinde van watermoleculen de positieve natriumionen aan (Na+).
3. Hydratatie: Deze aantrekkingskracht tussen watermoleculen en ionen wordt hydratatie genoemd. De watermoleculen omringen en isoleren de ionen effectief van elkaar, waardoor de ionische bindingen het NaCl -kristal aan elkaar houden.
Waarom jodium niet goed oplost in water
* Niet -polaire aard van jodium: Jodium (I2) is een niet -polair molecuul. Het heeft geen significante scheiding van lading zoals water, waardoor het voor watermoleculen moeilijk is om ermee te communiceren.
* Zwakke van der Waals krachten: Jodiummoleculen worden bij elkaar gehouden door zwakke van der Waals -krachten. Deze krachten zijn zwakker dan de waterstofbinding tussen watermoleculen, waardoor het voor water moeilijk is om ze te overwinnen en jodium op te lossen.
Samenvattend: NaCl lost meer op in water dan jodium omdat:
* NaCl is ionisch en water is polair: Sterke elektrostatische interacties treden op tussen watermoleculen en de ionen in NaCl.
* jodium is niet -polair: Watermoleculen kunnen niet effectief interageren met de niet -polaire jodiummoleculen.
 Welke alle metalen hebben lage smelt- en kookpunten?
Welke alle metalen hebben lage smelt- en kookpunten?  Is oxidatie een reactie in welke soort elektronen krijgt?
Is oxidatie een reactie in welke soort elektronen krijgt?  Welke heeft een grotere aantrekkingskracht voor elektronenfluor of zuurstof?
Welke heeft een grotere aantrekkingskracht voor elektronenfluor of zuurstof?  Wat is de reactie van ijzersulfaatoplossing met kaliumpermanganaat?
Wat is de reactie van ijzersulfaatoplossing met kaliumpermanganaat?  Welke eigenschap van een koolstofatoom legt uit waarom het bindt aan vier waterstofatomen in methaan (CH4) in plaats van drie vijf of andere aantal atomen?
Welke eigenschap van een koolstofatoom legt uit waarom het bindt aan vier waterstofatomen in methaan (CH4) in plaats van drie vijf of andere aantal atomen?
 Wat werd bedoeld met het concept van natuurlijke hulpbronnen voor rationeel gebruik?
Wat werd bedoeld met het concept van natuurlijke hulpbronnen voor rationeel gebruik?  Het was microbiële chaos in de Chicxulub-krater, onderzoek suggereert:
Het was microbiële chaos in de Chicxulub-krater, onderzoek suggereert: Supertyfoon Chanthu bedreigt Filipijnen Taiwan
Supertyfoon Chanthu bedreigt Filipijnen Taiwan Wat worden de kenmerken die gewoonlijk worden gebruikt om klimaten te classificeren?
Wat worden de kenmerken die gewoonlijk worden gebruikt om klimaten te classificeren?  Oesterjagers verkennen rivieren op tekenen van schelpdierleven
Oesterjagers verkennen rivieren op tekenen van schelpdierleven
Hoofdlijnen
- Onderzoekers onderzoeken hoe inktvissen in het donker communiceren
- Forsyth-wetenschappers krijgen meer inzicht in hoe embryo's zich onderscheiden van links en rechts
- Is intelligentie een genetisch kenmerk?
- Ecosysteem: definitie, types, structuur en voorbeelden
- Hoe door klimaatverandering veroorzaakte stress de hormonen van vissen verandert – met enorme gevolgen voor de voortplanting
- Ondergaat elk levend ding aseksuele reproductie?
- Wat is de naam van het proces dat zich voordoet in mitochovdria?
- Waarom zijn spechten bestand tegen hoofdletsel?
- Waar leven zakzwammen?
- Waterstof:brandstof van de toekomst?

- Onderzoekers analyseren hoe 3D-geprinte metalen breken

- Vervaardiging van door licht geactiveerde eiwitten

- Ontwikkeling van multifunctionele composietmaterialen voor ruimtevaarttoepassingen
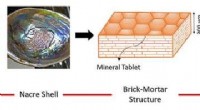
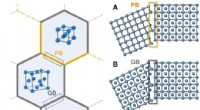
- Chemische grenstechniek gebruiken om staal te maken dat sterk en flexibel is zonder een hoog koolstofgehalte
 Productkeuze:waarom schatten consumenten hun capaciteiten verkeerd in?
Productkeuze:waarom schatten consumenten hun capaciteiten verkeerd in?  Wat is Invangementel?
Wat is Invangementel?  Hoe is wind hernieuwbaar?
Hoe is wind hernieuwbaar?  Hoe wordt regenval gemeten in het metrische systeem?
Hoe wordt regenval gemeten in het metrische systeem?  Intensivering van extreme regenval verschilt van regio tot regio, studie toont
Intensivering van extreme regenval verschilt van regio tot regio, studie toont Wat is iets dat dezelfde functie vervult als nucleolus in de cel?
Wat is iets dat dezelfde functie vervult als nucleolus in de cel?  Welke energievormen heeft een rubberen band?
Welke energievormen heeft een rubberen band?  Waarom beweegt de Zuid -magnetische paal?
Waarom beweegt de Zuid -magnetische paal?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

