
Wetenschap
Wat is de reactie tussen ijzer II -chloride en natriumfosfaat?
Hier is de evenwichtige chemische vergelijking:
3 fecl₂ (aq) + 2 na₃po₄ (aq) → fe₃ (po₄) ₂ (s) + 6 NaCl (aq)
Dit is wat er gebeurt:
* ijzer (II) chloride (Fecl₂) en natriumfosfaat (Na₃po₄) zijn beide oplosbaar in water, dus ze bestaan als ionen in oplossing.
* ijzer (II) ionen (fe²⁺) en fosfaationen (po₄³⁻) hebben een sterke aantrekkingskracht voor elkaar, die een onoplosbaar neerslag vormt , ijzer (II) fosfaat (Fe₃ (PO₄) ₂). Dit neerslag vormt een vaste stof die uit oplossing valt.
* Natriumionen (Na⁺) en chloride -ionen (Cl⁻) Blijf in oplossing omdat ze oplosbaar zijn en natriumchloride (NaCl) vormen.
Observaties:
* Je zou een bewolkt wit neerslag zien vormend in de oplossing terwijl het ijzer (II) fosfaat neerslaat.
* De oplossing zou minder duidelijk worden vanwege het neerslag.
Opmerking: Deze reactie is ook een voorbeeld van een neerslagreactie , waarbij een onoplosbare vaste stof (neerslag) vormt uit de reactie van twee oplosbare reactanten.
 Hoe kun je apparaten gebruiken om zand en suiker te scheiden?
Hoe kun je apparaten gebruiken om zand en suiker te scheiden?  Wat is het materiaal dat water kan produceren?
Wat is het materiaal dat water kan produceren?  Wat is het woordvergelijking voor fluor en kalium?
Wat is het woordvergelijking voor fluor en kalium?  Wat gebeurt er als een proton aan koolstof wordt toegevoegd?
Wat gebeurt er als een proton aan koolstof wordt toegevoegd?  Onderzoeksgroep gebruikt supercomputing om zich te richten op de meest veelbelovende kandidaat-geneesmiddelen uit een enorm aantal mogelijkheden
Onderzoeksgroep gebruikt supercomputing om zich te richten op de meest veelbelovende kandidaat-geneesmiddelen uit een enorm aantal mogelijkheden
 Wat zijn de oplossingen voor door klimaatverandering beïnvloede druiven?
Wat zijn de oplossingen voor door klimaatverandering beïnvloede druiven? Kunstmatige intelligentie begeleidt snelle gegevensgestuurde verkenning van onderwaterhabitats
Kunstmatige intelligentie begeleidt snelle gegevensgestuurde verkenning van onderwaterhabitats Hoe vergelijk je en contrasteer je de twee belangrijkste takken van de fysieke wetenschap?
Hoe vergelijk je en contrasteer je de twee belangrijkste takken van de fysieke wetenschap?  Deep Ocean Plants
Deep Ocean Plants De klimaatcrisis is echt, maar overmatig gebruik van termen als crisis en noodtoestand brengt risico's met zich mee
De klimaatcrisis is echt, maar overmatig gebruik van termen als crisis en noodtoestand brengt risico's met zich mee
Hoofdlijnen
- Wat is de beste manier om de overdracht van tuberculose door in het wild levende runderen te voorkomen?
- Wat is de grootste boom geboren fruit?
- Wat doen vertakkende cellen?
- Foster-kikkervisjes triggeren het ouderlijk instinct bij gifkikkers
- Hoe werkt de natuurlijke selectie op het fenotype van een organisme?
- Wat zit er tussen elke vertibrey?
- Paddestoelen vormen de hoofdpersoon in de meeste ecosystemen
- Waar zou u verwachten dat u eiwitten vindt die betrokken zijn bij de beweging van structuren in een cel?
- Wat is het reproductiesysteem?
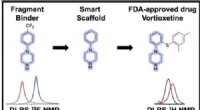
- De deuren openen naar effectieve COVID-19-behandelingen
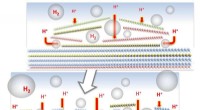
- Samenstellingsontwerp van legeringen met meerdere componenten door screening met hoge doorvoer

- Bubbels helpen nieuwe katalysatoren zichzelf te optimaliseren
- Eenvoudige methode om koolstofdioxide om te zetten in bruikbare verbindingen

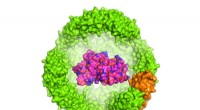
- Onderzoekers vouwen een eiwit in een eiwit
 On-the-fly filtersysteem verbetert de uitlijning van het weerbeeld
On-the-fly filtersysteem verbetert de uitlijning van het weerbeeld Wat is de uitgebalanceerde chemische vergelijking voor de verbranding van azijnzuur?
Wat is de uitgebalanceerde chemische vergelijking voor de verbranding van azijnzuur?  Een groep vezels in de cel die helpt ondersteunen is.
Een groep vezels in de cel die helpt ondersteunen is.  Wat is het belangrijkste doel van de aardwetenschap?
Wat is het belangrijkste doel van de aardwetenschap?  Enorme ijsberg breekt eindelijk af van Antarctica Larsen C Ice Shelf
Enorme ijsberg breekt eindelijk af van Antarctica Larsen C Ice Shelf  Wat zorgt ervoor dat gamers blijven gamen?
Wat zorgt ervoor dat gamers blijven gamen?  Nieuw onderzoek onderzoekt waarom sommige bedrijven zich voorbereiden op natuurrampen en andere niet
Nieuw onderzoek onderzoekt waarom sommige bedrijven zich voorbereiden op natuurrampen en andere niet  Studie:Twijfels over ISO 9001-kwaliteitscertificaten van Chinese bedrijven
Studie:Twijfels over ISO 9001-kwaliteitscertificaten van Chinese bedrijven
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

