
Wetenschap
Zijn waterstofbindingen sterk of zwak?
Dit is waarom:
* Aard van de binding: Waterstofbindingen worden gevormd door de elektrostatische aantrekkingskracht tussen een waterstofatoom covalent gekoppeld aan een sterk elektronegatief atoom (zoals zuurstof, stikstof of fluor) en een elektronpaar in het aangrenzende atoom. Deze aantrekkingskracht is zwakker dan de gedeelde elektronen in covalente bindingen of de volledige overdracht van elektronen in ionische bindingen.
* bindingssterkte: Waterstofbindingen zijn typisch in het bereik van 1-5 kcal/mol, terwijl covalente bindingen 50-100 kcal/mol kunnen zijn.
* rol in biologische systemen: Ondanks hun zwakte spelen waterstofbindingen cruciale rollen in biologische systemen. Ze helpen de structuur van eiwitten, DNA en andere moleculen te stabiliseren, wat bijdragen aan hun functie.
Samenvattend: Waterstofbindingen zijn zwakker dan covalente of ionische bindingen, maar ze zijn nog steeds belangrijk in veel biologische processen.
 Schadig type neerslag veroorzaakt door oxiden zwavel en stikstof?
Schadig type neerslag veroorzaakt door oxiden zwavel en stikstof?  Nieuwe tool analyseert ziekte- en medicijneffecten met ongekende nauwkeurigheid en consistentie
Nieuwe tool analyseert ziekte- en medicijneffecten met ongekende nauwkeurigheid en consistentie Wat is de naam van het smelten van procesijs tot water?
Wat is de naam van het smelten van procesijs tot water?  Wat zijn de reacties van TFA?
Wat zijn de reacties van TFA?  Hoe beïnvloedt verwarming de oplosbaarheid van een opgeloste gas in vloeistof?
Hoe beïnvloedt verwarming de oplosbaarheid van een opgeloste gas in vloeistof?
Hoofdlijnen
- Wat doet het lymfestelsel?
- Cryptische seks:hoe vrouwelijke en unisex-dieren zich voortplanten zonder mannen
- Welke organel wordt de krachtpatser van Cell genoemd en speelt een rol in generatie -energie?
- Wat zijn de twee hoofdfasen van de celcyclus?
- Zijn ziekteverwekkers bacteriën en schimmelsvirus?
- Onderzoek suggereert waarom sommige dieren langer leven
- Zeevruchten, wild of gekweekt? Het antwoord kan beide zijn
- Van welke delen van het lichaam kun je DNA halen?
- Wat maakt van een experiment een gecontroleerd experiment?
- Verknoopte gatentransportlagen voor hoogrenderende perovskiet-tandemzonnecellen
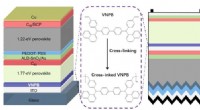
- Kleine elektrische velden kunnen een beslissende rol spelen bij de vorming van diamant

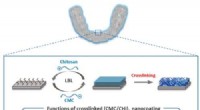
- Tandhouders en aligners helpen om bacteriën te bestrijden
- Cohesieonderzoekers ontrafelen het mysterie van waterstofeffecten op materialen

- Een snelle, efficiënte COVID-19-biosensor is in ontwikkeling

 Wat is de thermische energie die uit iets voortvloeit bij een hoge temperatuur tot iets lagere tempeature?
Wat is de thermische energie die uit iets voortvloeit bij een hoge temperatuur tot iets lagere tempeature?  What Is the Unit of Power?
What Is the Unit of Power?  Wat zijn 3 redenen waarom geothermische energie een kostenefficiëntie?
Wat zijn 3 redenen waarom geothermische energie een kostenefficiëntie?  Wat lossen niet -metaaloxiden op in water om te vormen?
Wat lossen niet -metaaloxiden op in water om te vormen?  In welke toestand van materie kunnen deeltjes alleen trillen?
In welke toestand van materie kunnen deeltjes alleen trillen?  Wat is het zwaarste element dat kan worden gemaakt door normale processen in een ster?
Wat is het zwaarste element dat kan worden gemaakt door normale processen in een ster?  Hoe verschilt een open circuit van een kortsluiting?
Hoe verschilt een open circuit van een kortsluiting?  Wat is het bereik van methyloranje?
Wat is het bereik van methyloranje?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

