
Wetenschap
Wat is de reactie tussen cupric chloride en koper?
Reactievergelijking:
CUCL₂ (aq) + cu (s) → 2 cucl (aq)
Verklaring:
* Kopermetaal (Cu) Fungeert als het reductiemiddel, het verliezen van elektronen en worden geoxideerd tot cupric ionen (Cu²⁺).
* cupric chloride (CUCL₂) werkt als het oxidatiemiddel, het verkrijgen van elektronen en worden gereduceerd tot kopiechloride (CUCL).
Over het algemeen resulteert de reactie in de vorming van koperchloride (CUCL) in oplossing.
Belangrijke opmerking:
* Deze reactie is een evenwichtsreactie. De mate van de reactie hangt af van de concentratie van de reactanten, temperatuur en de aanwezigheid van andere ionen in oplossing.
* De reactie wordt vaak gebruikt bij de productie van kopiechloride, een verbinding die wordt gebruikt in verschillende industriële toepassingen.
Verdere details:
* De reactie kan worden versneld door de oplossing te verwarmen en door een geschikte katalysator te gebruiken.
* De vorming van CUCL is duidelijk door het verschijnen van een wit neerslag in de oplossing.
* De reactie is een voorbeeld van een verplaatsingsreactie, waarbij een meer reactief metaal (koper) een minder reactief metaalion (cupric ion) uit zijn zoutoplossing verplaatsen.
Laat het me weten als je nog andere vragen hebt!
 Is een kookpunt chemische eigenschap van inhoud?
Is een kookpunt chemische eigenschap van inhoud?  Welke chemische verbindingen worden geacht verantwoordelijk te zijn voor de smaken van bitter, zuur, zout en zoet
Welke chemische verbindingen worden geacht verantwoordelijk te zijn voor de smaken van bitter, zuur, zout en zoet  Vriestpunt van pure substantie 21 graden Wat is het smeltpunt?
Vriestpunt van pure substantie 21 graden Wat is het smeltpunt?  Welke van de volgende wordt onderzocht om fusiereacties op aarde te bevatten?
Welke van de volgende wordt onderzocht om fusiereacties op aarde te bevatten?  Virtuele bibliotheek van 1 miljoen nieuwe macrolide-steigers kan de ontdekking van geneesmiddelen helpen versnellen
Virtuele bibliotheek van 1 miljoen nieuwe macrolide-steigers kan de ontdekking van geneesmiddelen helpen versnellen
 Twee omgevingsfactoren die de transpiratie beïnvloeden
Twee omgevingsfactoren die de transpiratie beïnvloeden Diepzee-glasvezelkabels gebruiken om aardbevingen te detecteren
Diepzee-glasvezelkabels gebruiken om aardbevingen te detecteren Wetenschappers vinden wijdverbreide anoxie in de oceaan als oorzaak van massale uitsterving in het verleden
Wetenschappers vinden wijdverbreide anoxie in de oceaan als oorzaak van massale uitsterving in het verleden Cool plan:studie zegt dat betere airconditioning de opwarming van de aarde kan vertragen
Cool plan:studie zegt dat betere airconditioning de opwarming van de aarde kan vertragen Geen pauze in de opwarming van de aarde in de afgelopen 100 jaar
Geen pauze in de opwarming van de aarde in de afgelopen 100 jaar
Hoofdlijnen
- Hoe bacteriën cellulaire lading vervoeren door langs eiwitten te 'surfen'
- Hoe een agressieve schimmelziekte schimmel veroorzaakt in groenten en fruit
- Hoe cellulaire structuren betrokken zijn bij het synthetiseren en verpakken van eiwitten?
- Onderzoekers ontdekken door het meten van krachten hoe het darmepitheel vouwt en beweegt
- Waarom wordt evolutie als een wetenschappelijke theorie beschouwd?
- Vleugelstructuur van vitaal belang bij het produceren van een reeks tonen bij paringsoproepen van bush-cricket
- Welk taxon heeft de meeste organismen?
- Hoe voldoen orgelsystemen aan de bodysbehoeften?
- Losse huid en slap volume beschermen Hagfish tegen haaienbeten
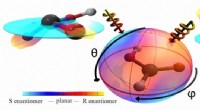
- Dupliceren of spiegelen? Laserlicht bepaalt chiraliteit van moleculen
- Hoe een COVID-19-infectie de bloedcellen op de lange termijn verandert

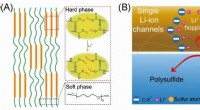
- Stabiliserende zwavelkathode door enkelvoudig Li-ionkanaalpolymeerbindmiddel
- Nieuw licht op het maken van tweedimensionale polymeren

- Vochtvanger op zonne-energie verzamelt en reinigt water uit de lucht

 Waar zijn sternale draden van gemaakt?
Waar zijn sternale draden van gemaakt?  Wat is de formule van xyleen?
Wat is de formule van xyleen?  Nieuwe windturbines tonen een hoog rendement bij weinig wind
Nieuwe windturbines tonen een hoog rendement bij weinig wind Zout of suiker wat lost op in ethanol?
Zout of suiker wat lost op in ethanol?  Wat is tussen watermoleculen, veroorzaken oppervlaktespanning?
Wat is tussen watermoleculen, veroorzaken oppervlaktespanning?  Modellen tonen aan dat koralen beter bestand zijn tegen de opwarming van de oceaan als ze ruilen voor hittebestendige algenvariëteiten
Modellen tonen aan dat koralen beter bestand zijn tegen de opwarming van de oceaan als ze ruilen voor hittebestendige algenvariëteiten  Wat is de definitie voor een natuurlijke habitat en een door de mens gemaakte habitat?
Wat is de definitie voor een natuurlijke habitat en een door de mens gemaakte habitat?  Wat is de eenvoudigste manier om een 3 -fase 380 V -motor van ongeveer 1 kW rechtstreeks op 220 single -voeding te laten werken zonder terugspoelen of frequentieomzetters?
Wat is de eenvoudigste manier om een 3 -fase 380 V -motor van ongeveer 1 kW rechtstreeks op 220 single -voeding te laten werken zonder terugspoelen of frequentieomzetters?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

