
Wetenschap
Welke verfijningen moesten worden gemaakt in de atomaire theorie goed voor resultaten over de combinerende volumes van gassen?
Het probleem:
* Dalton's atomaire theorie: Dalton's vroege atoomtheorie (1808) suggereerde dat atomen gecombineerd in de eenvoudigste verhoudingen van het hele nummer om verbindingen te vormen. Hoewel dit veel chemische reacties verklaarde, was het niet volledig verantwoordelijk voor de waargenomen volumes van gassen die reageren.
* de wet van Gay-Lussac: Gay-Lussac (1808) ontdekte dat wanneer gassen reageren, de volumes van de reactanten en producten zich altijd in eenvoudige gehele nummerverhoudingen bevinden. 2 volumes waterstof reageren bijvoorbeeld met 1 volume zuurstof om 2 volumes waterdamp te produceren. Dit kon niet worden verklaard door de theorie van Dalton.
De verfijning:de hypothese van Avogadro (1811)
Amedeo Avogadro stelde het volgende voor:
* Gelijke volumes gassen bij dezelfde temperatuur en druk bevatten hetzelfde aantal moleculen. Dit betekent dat als je twee containers van gelijke grootte hebt gevuld met verschillende gassen onder dezelfde omstandigheden, ze hetzelfde aantal moleculen hebben.
* gassen reageren in eenvoudige verhoudingen van het hele nummer omdat deze verhoudingen het aantal betrokken moleculen vertegenwoordigen. Dit verklaarde de wet van Gay-Lussac door de volumeverhoudingen te verbinden met het aantal moleculen dat bij de reactie betrokken is.
gevolgen van de hypothese van Avogadro:
* Diatomaire moleculen: De hypothese van Avogadro legde uit waarom waterstof en zuurstof reageren in een 2:1 -volumeverhouding om water te produceren. Het suggereerde dat waterstof en zuurstof bestaan als diatomaire moleculen (H₂ en O₂) in plaats van individuele atomen.
* Molecuulgewichten: Door de combinerende volumes van gassen te kennen en de hypothese van Avogadro te gebruiken, kunnen wetenschappers de relatieve molecuulgewichten van gassen afleiden, die het begrip van atoomgewichten verder verfijnden.
Samenvatting:
De hypothese van Avogadro was een cruciale verfijning van de atomaire theorie van Dalton, die de waargenomen combinatie van volumes van gassen verklaarde en het concept van moleculen stolt. Het bood een raamwerk voor het begrijpen van het gedrag van gassen en legde de basis voor de ontwikkeling van het molconcept in de chemie.
Hoofdlijnen
- Hoe IJsland een hoofdrol zou kunnen spelen als duurzame alternatieve eiwitexporteur naar Noord-Europa
- Onderzoekers stellen vast hoe insecten profiteren van het aas dat carnivoren achterlaten
- Waarom het uitsterven van parasieten een probleem kan zijn voor bedreigde woylies
- Veranderen met de leeftijd:naarmate vleermuizen ouder worden, verschillen hun immuuncellen
- Hoe de jacht mensen tot langeafstandslopers heeft gemaakt
- Noem de organisatieniveaus in de ecologie, te beginnen met de biosfeer?
- Wat zijn enkele professionals voor de wetenschap?
- Vergelijking van plantencellen en menselijke cellen
- Wat is Khumbi Mann Mushroom of Agaricus Campesteris?
- Ontziltingsonderzoek kan ingenieurs helpen om efficiënter schoon water te produceren
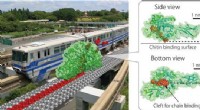
- Chitinase als verbrande brug Brownse monorail die op efficiënte wijze recalcitrante biomassa hydrolyseert
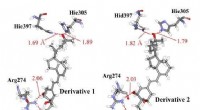
- Chiraliteit van vitamine D-derivaat beïnvloedt de protoneringstoestanden van zijn receptoreiwit
- Waterstofkracht komt een stap dichterbij

- Complex leven is ontstaan uit de toevallige koppeling van kleine moleculen

 Waarom is het gevaarlijker om naar de zon te kijken tijdens een zonsverduistering?
Waarom is het gevaarlijker om naar de zon te kijken tijdens een zonsverduistering?  Wat is de vergoeding van natuurlijke hulpbronnen?
Wat is de vergoeding van natuurlijke hulpbronnen?  Meerderheidsregels bij het zoeken naar aardbevingen, explosies
Meerderheidsregels bij het zoeken naar aardbevingen, explosies Wat gebeurt er als een oplossing verandert van PH5 in PH6?
Wat gebeurt er als een oplossing verandert van PH5 in PH6?  Nieuwe techniek kan helpen bij het ontwerpen van vervuild waterfilter, menselijke weefsels
Nieuwe techniek kan helpen bij het ontwerpen van vervuild waterfilter, menselijke weefsels Wat is oplosbare boorvergiftiging in een nucleaire reactor?
Wat is oplosbare boorvergiftiging in een nucleaire reactor?  Tweewaardig goudcomplex voor het eerst geïsoleerd in zuivere vorm
Tweewaardig goudcomplex voor het eerst geïsoleerd in zuivere vorm Hoe spoor je een geheimzinnige havik op? Volg de isotopen
Hoe spoor je een geheimzinnige havik op? Volg de isotopen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


