
Wetenschap
Wat is de moleculaire vorm van nitrogenen?
Stikstofgas (N₂) heeft een lineair moleculaire vorm.
Dit is waarom:
* Elektronische configuratie van stikstof: Stikstof heeft vijf valentie -elektronen. In N₂ vormt het een drievoudige binding met een ander stikstofatoom en deelt het drie elektronenparen.
* vSEPR -theorie: Volgens de Valent Shell Electron Pair Repulsion (VSEPR) -theorie stoot elektronen rond een centrale atoom af en proberen zo ver mogelijk uit elkaar te blijven.
* Lineaire vorm: In N₂ zijn de twee stikstofatomen en de drie gedeelde elektronenparen (drievoudige binding) allemaal in een rechte lijn, waardoor afstoting wordt geminimaliseerd.
Daarom heeft stikstofgas (N₂) een lineaire moleculaire vorm.
 Wat is een donkerreactieproces?
Wat is een donkerreactieproces?  Welke chemische reactie gebeurt met suiker wanneer u het verwarmt?
Welke chemische reactie gebeurt met suiker wanneer u het verwarmt?  Wat is een chemische formule voor blauwe zirkonen?
Wat is een chemische formule voor blauwe zirkonen?  Hoeveel gram NaCl zal oplossen in 100 ml water?
Hoeveel gram NaCl zal oplossen in 100 ml water?  Coördinatiepolymeerkristallen zijn veelbelovend als nieuwe generatie lichtbronnen voor de industrie en de geneeskunde
Coördinatiepolymeerkristallen zijn veelbelovend als nieuwe generatie lichtbronnen voor de industrie en de geneeskunde
Hoofdlijnen
- Welke is eencellig: Prokaryoten of eukaryoten?
- Wetenschappers werken aan een periodiek systeem voor ecologie
- Planten herprogrammeren hun cellen om indringers te bestrijden. Hier is hoe
- Bioluminescente organismen worden voornamelijk gevonden in welk deel van de oceaan?
- Hoe wordt de kloof tussen tanden van een herbivoor genoemd?
- Welke ontdekkingen zijn zeevloerkenmerken gevonden met Aqualung?
- Onderscheid maken tussen pathogene deficiëntie erfelijke en fysiologische ziekte?
- Wat waar de twee belangrijkste uitgedrukt in publicatie over de oorsprong van soorten?
- Gebruik de grote ideeëncellen om variatie uit te leggen?
- De uitkomst van de wapenwedloop tussen mens en bacterie voorspellen
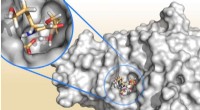
- Polymeerkristallen vormen de sleutel tot recordbrekend energietransport
- Nano-engineered cement is veelbelovend voor het afdichten van lekkende gasbronnen

- SLIPS en valkuilen:synthetische oppervlakken geïnspireerd op een valkuilval voor werpers
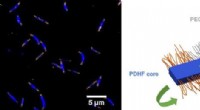
- Een gemakkelijkere manier om vegetarisch te worden:vitamine B12 kan worden geproduceerd tijdens deegfermentatie

 Hoe groeit een vleugel? Een reis op het pad van eiwitten
Hoe groeit een vleugel? Een reis op het pad van eiwitten  Perfecte paspoppen een afknapper voor sommige consumenten
Perfecte paspoppen een afknapper voor sommige consumenten Wat is de naam van onze zon en hoe beïnvloedt dit het leven op de aarde?
Wat is de naam van onze zon en hoe beïnvloedt dit het leven op de aarde?  Wat is de relatie tussen energiemassa en lengte?
Wat is de relatie tussen energiemassa en lengte?  Wat is het verschil tussen invasie van kankercellen en metastasecellen?
Wat is het verschil tussen invasie van kankercellen en metastasecellen?  Kunstmatige huid zweet op commando
Kunstmatige huid zweet op commando Verzengende temperatuur in Death Valley in de VS kan wereldwijd hoog zijn
Verzengende temperatuur in Death Valley in de VS kan wereldwijd hoog zijn Wetenschappers ontdekken hoe cyberinbraken kunnen worden gestopt
Wetenschappers ontdekken hoe cyberinbraken kunnen worden gestopt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

