
Wetenschap
Wat zijn de grondstoffen die worden gebruikt bij de productie van ammoniak?
* stikstof (n2): Dit wordt verkregen uit lucht, wat ongeveer 78% stikstof is. Lucht wordt gecomprimeerd en gekoeld om de luchtcomponenten vloeibaar te maken en vervolgens wordt stikstof gescheiden door fractionele destillatie.
* waterstof (H2): Dit kan worden verkregen uit verschillende bronnen:
* Natural Gas: De meest voorkomende bron van waterstof. Aardgas wordt gereageerd met stoom om synthesegas te produceren (een mengsel van CO en H2), en de CO wordt verder gereageerd om meer waterstof te produceren.
* Coal: Steenkool kan worden opgegeven om synthesegas te produceren, dat vervolgens kan worden verwerkt om waterstof te verkrijgen.
* Water: Elektrolyse van water kan waterstof en zuurstof produceren. Dit proces wordt steeds belangrijker naarmate de hernieuwbare energiebronnen meer beschikbaar worden.
* katalysator: Het Haber-Bosch-proces, de primaire methode voor ammoniakproductie, maakt gebruik van een katalysator, typisch ijzeroxide (Fe3O4) met kleine hoeveelheden promotors zoals kaliumoxide (K2O) en aluminiumoxide (AL2O3). De katalysator versnelt de reactiesnelheid, maar wordt in het proces niet geconsumeerd.
De algemene reactie voor ammoniakproductie is:
N2 (G) + 3H2 (G) ⇌ 2NH3 (G)
Deze reactie is exotherme en omkeerbaar, wat betekent dat het in beide richtingen kan doorgaan. De omstandigheden die in het Haber-Bosch-proces worden gebruikt, zijn zorgvuldig geoptimaliseerd om de ammoniakproductie te maximaliseren:
* Hoge druk: Meestal ongeveer 200 atmosferen (20 MPa)
* Matige temperatuur: Ongeveer 450 ° C (842 ° F)
* katalysator: Om de reactiesnelheid te versnellen
* Verwijdering van ammoniak: Dit verschuift het evenwicht naar de productzijde en verhoogt de totale opbrengst.
De productie van ammoniak is een belangrijk industrieel proces dat een cruciale rol speelt bij de productie van meststoffen, explosieven en andere belangrijke chemicaliën.
 Wetenschappers voorzien onnoemelijk lijden, weer een klimaatrecord gezakt
Wetenschappers voorzien onnoemelijk lijden, weer een klimaatrecord gezakt Waarom worden gele kikkers het meest waarschijnlijk in het bos gegeten?
Waarom worden gele kikkers het meest waarschijnlijk in het bos gegeten?  Klimaatverandering zal naar verwachting de seizoensgebonden Oost-Afrikaanse regenval doen toenemen
Klimaatverandering zal naar verwachting de seizoensgebonden Oost-Afrikaanse regenval doen toenemen Nieuwe wereldwijde database zal wetenschappers helpen de rol van meren in de ecologie van de aarde te volgen
Nieuwe wereldwijde database zal wetenschappers helpen de rol van meren in de ecologie van de aarde te volgen Welke verklaring beschrijft het beste een primaire bron?
Welke verklaring beschrijft het beste een primaire bron?
Hoofdlijnen
- Nieuw onderzoek onderzoekt hoe ziekten zich verspreiden bij primaten
- Wat is erytrocyanine?
- Vier klassen Macromoleculen die belangrijk zijn voor levende wezens
- Zenuwonderzoek laat zien hoe cellen zich aanpassen om schade te helpen herstellen
- Organismen worden geclassificeerd als schimmels als zij?
- Welke van deze soorten heeft een langere binding B2 of B2?
- Waar kwam de wetenschappelijke naam van konijn vandaan?
- De effecten van ultraviolette straling op gist
- Onderzoekers gebruiken modelleringstools voor machinaal leren om de technologie voor het bewerken van zinkvingernucleases te verbeteren
- Wetenschappers laten zien hoe vloeibare brandstoffen in polymere gels kunnen worden opgeslagen om explosies en branden te voorkomen
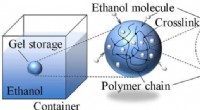
- Een nieuw magnetisch materiaal en opnameproces om de datacapaciteit enorm te vergroten

- Cryo-EM-structuren van de nicotinereceptor kunnen leiden tot nieuwe therapieën voor verslaving

- Molecular activity painting om schakelaarachtige, lichtgestuurde verstoringen in cellen
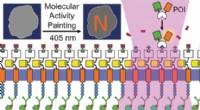
- Onderzoekers gebruiken geluidsgolven om te voorkomen dat kleine chemische reactoren verstopt raken

 Hoe het tweeogige zien, 'Etuaptmumk', het buitenspelen in de voorschoolse educatie verandert
Hoe het tweeogige zien, 'Etuaptmumk', het buitenspelen in de voorschoolse educatie verandert  Prestatieverhogend... onderzoek? Nieuwe metingen kunnen topsporters helpen
Prestatieverhogend... onderzoek? Nieuwe metingen kunnen topsporters helpen  Wat zou er gebeuren als basalt en graniet botsten?
Wat zou er gebeuren als basalt en graniet botsten?  Vermeld het verschil tussen snelheid en snelheid?
Vermeld het verschil tussen snelheid en snelheid?  Het ruimtevaartuig New Horizons beantwoordt de vraag:hoe donker is de ruimte?
Het ruimtevaartuig New Horizons beantwoordt de vraag:hoe donker is de ruimte?  Wat zijn enkele kenmerken van zonne -energie?
Wat zijn enkele kenmerken van zonne -energie?  Waarom is de onze een eindige aarde?
Waarom is de onze een eindige aarde?  Wie is oudere graniet of kalksteen?
Wie is oudere graniet of kalksteen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

