
Wetenschap
Wat is de moleculaire orbitale structuur voor koolstofdioxide?
1. Atomische orbitalen betrokken
* koolstof: Koolstof heeft 2S en 2p atomaire orbitalen.
* zuurstof: Zuurstof heeft ook 2S en 2p atomaire orbitalen.
2. Moleculaire orbitale vorming
* sigma -binding (σ): De 2S -orbitalen van koolstof en zuurstof combineren om twee σ bindings orbitalen te vormen. Een van deze σ -orbitalen is lager in energie (binding) en de andere is hoger (antibonding, aangegeven door *).
* pi binding (π): De 2P -orbitalen van koolstof en zuurstof combineren om twee sets van π bindingsorbitalen te vormen. De ene set is lager in energie (binding) en de andere is hoger (antibonding, aangegeven door *).
3. Moleculair orbitaal diagram
Het moleculaire orbitale diagram voor Co₂ ziet er zo uit:
`` `
*σ2p (antibonding)
*π2p (antibonding)
π2p (binding)
σ2p (binding)
*σ2s (antibonding)
σ2s (binding)
`` `
4. De orbitalen vullen
* Co₂ heeft in totaal 16 valentie -elektronen (4 van koolstof en 6 van elke zuurstof).
* Deze elektronen vullen de moleculaire orbitalen in volgorde van toenemende energie.
* De laagste twee σ -orbitalen en de twee π -binding orbitalen zijn gevuld, wat in totaal 10 elektronen oplevert.
*De resterende 6 elektronen bezetten de *σ2s, *π2p en *σ2p antibonding orbitalen.
5. Eigenschappen en binding
* lineaire geometrie: De moleculaire orbitale structuur van CO₂ resulteert in een lineaire vorm met het koolstofatoom in het midden en de twee zuurstofatomen aan beide kanten.
* Sterke bindingen: De gevulde binding orbitalen creëren sterke, stabiele bindingen tussen de koolstof- en zuurstofatomen.
* nonpolar: Het molecuul is niet -polair omdat de elektronendichtheid gelijkmatig is verdeeld.
Sleutelpunten:
* Het moleculaire orbitale diagram helpt de binding, stabiliteit en eigenschappen van CO₂ te verklaren.
* De sterke bindingen in Co₂ maken het een zeer stabiel molecuul.
Laat het me weten als je een meer gedetailleerde uitleg wilt van een bepaald aspect van de moleculaire orbitale structuur!
 Wat is het verschil tussen kookproces en verdampingswater?
Wat is het verschil tussen kookproces en verdampingswater?  Waarom Naacl en KCL hebben geen invloed op de hardheid van water?
Waarom Naacl en KCL hebben geen invloed op de hardheid van water?  Waarom wil je als scheikundestudent aan de slag in de banksector?
Waarom wil je als scheikundestudent aan de slag in de banksector?  De geheimen van oude rotskunst ontdekken met behulp van röntgenzicht
De geheimen van oude rotskunst ontdekken met behulp van röntgenzicht Hoe kun je deze items in groepen sorteren, olieplanten, dieren, steenkool, water, aardgas en zuurstof?
Hoe kun je deze items in groepen sorteren, olieplanten, dieren, steenkool, water, aardgas en zuurstof?
Hoofdlijnen
- Wat produceren insecten -eetplanten om insecten te vangen en te verteren?
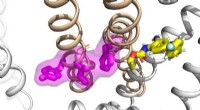
- Gepolariseerde microscopietechniek toont nieuwe details van hoe eiwitten zijn gerangschikt
- Wat is de relatie tussen kankercellen en een tumor?
- Waarom hebben multi-cellulaire organismen celdeling nodig?
- Is embryo -stamcelonderzoek moraal?
- Verschrikkelijke sneeuwman? Nee, onderzoek koppelt DNA-monsters van vermeende Yeti's aan Aziatische beren
- Wat is het doel van mitose?
- Microscopie onthult mechanisme achter nieuwe CRISPR-tool
- Ideeën voor celademhaling
- Wetenschappers maken biologisch afbreekbare microbeads van cellulose
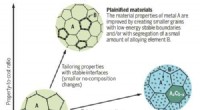
- Verduidelijking belooft veel goeds voor het verbeteren van de duurzaamheid van materialen
- Video:Waarom ruiken de poten van mijn hond naar Fritos?

- Zonlicht kan worden gebruikt om verontreinigende stoffen in water uit te roeien

- Onderzoek onthult nieuw mechanisme achter epilepsie en medicijnmodulatie
 Wat is de moleculaire formule van relatieve massa 72?
Wat is de moleculaire formule van relatieve massa 72?  Welke innerlijke planeet (s) hebben een rotsachtig oppervlak?
Welke innerlijke planeet (s) hebben een rotsachtig oppervlak?  Deep learning geeft medicijnontwerp een boost
Deep learning geeft medicijnontwerp een boost Koeling:de verborgen dreiging voor klimaatverandering en duurzame doelen
Koeling:de verborgen dreiging voor klimaatverandering en duurzame doelen Ingenieurs van Yale ontwikkelen nieuw type mechanisch geheugen
Ingenieurs van Yale ontwikkelen nieuw type mechanisch geheugen Welke kleuren veranderen lakmuspapier en fenolpthaleïne in aanwezigheid van een zuur of base?
Welke kleuren veranderen lakmuspapier en fenolpthaleïne in aanwezigheid van een zuur of base?  Op welke manieren verschillen zonne- en maanverduisteringen?
Op welke manieren verschillen zonne- en maanverduisteringen?  Wat geldt voor alle sedimenten van gletsjeroorsprong?
Wat geldt voor alle sedimenten van gletsjeroorsprong?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

