
Wetenschap
Welk type ion zal chloor het meest waarschijnlijk vormen?
Dit is waarom:
* Elektronenconfiguratie: Chloor heeft 7 elektronen in zijn buitenste schaal. Het heeft nog een elektron nodig om een stabiele octetconfiguratie (8 elektronen) te bereiken, zoals de edelgassen.
* elektronegativiteit: Chloor is een zeer elektronegatief element, wat betekent dat het een sterke aantrekkingskracht heeft op elektronen.
* ionisatie -energie: De ionisatie -energie van chloor is relatief hoog, wat aangeeft dat het veel energie vereist om een elektron te verwijderen.
Daarom is chloor veel meer kans om een elektron te krijgen om een negatief geladen ion (Cl-) te worden dan een elektron te verliezen en een positief geladen ion te worden.
 Hoeveel koolstofatomen zijn aanwezig in tetrabromide van 4,25 mol?
Hoeveel koolstofatomen zijn aanwezig in tetrabromide van 4,25 mol?  Wat is de evenwichtige vergelijking voor wanneer methanol brandt?
Wat is de evenwichtige vergelijking voor wanneer methanol brandt?  Is mineraalwater een oplossing of colloïde?
Is mineraalwater een oplossing of colloïde?  Bimetallische strips bestaande uit twee verschillende metalen die elk een snelheidstermische expansie hebben, worden gebruikt?
Bimetallische strips bestaande uit twee verschillende metalen die elk een snelheidstermische expansie hebben, worden gebruikt?  Hoe wordt - stikstofoxide geproduceerd?
Hoe wordt - stikstofoxide geproduceerd?
 Het berekenen van de CO2-uitstoot van biobrandstoffen is niet genoeg
Het berekenen van de CO2-uitstoot van biobrandstoffen is niet genoeg Vingerafdruk voor de vorming van lachgasemissies
Vingerafdruk voor de vorming van lachgasemissies We krijgen elk 7 vierkante meter akkerland per dag. Te veel drank en pizza zorgt ervoor dat we het overtreffen
We krijgen elk 7 vierkante meter akkerland per dag. Te veel drank en pizza zorgt ervoor dat we het overtreffen Hoe vlinders de wereld veroverden:een nieuwe 'stamboom' volgt hun 100 miljoen jaar durende reis over de hele wereld
Hoe vlinders de wereld veroverden:een nieuwe 'stamboom' volgt hun 100 miljoen jaar durende reis over de hele wereld  De overheid rekent de vermindering van de uitstoot van broeikasgassen verkeerd uit
De overheid rekent de vermindering van de uitstoot van broeikasgassen verkeerd uit
Hoofdlijnen
- Wat is de naam van een grote opslagverbinding die in cytoplasma wordt gevonden?
- Kun je het 5 -koninkrijk van organisme met voorbeeld vermelden?
- Hoe komen de wetenschappers ten goede aan de samenleving?
- Indringende vraag:Wat doodt de honingbijen?
- Hoe bloedstamcellen hun levenslange potentieel voor zelfvernieuwing behouden
- Welk voedsel maken planten voor zichzelf?
- Wat is het genotype van een plant die heterozygoot met gerimpelde zaad rode bloem heeft als dominant en recessief?
- Wat is het tegenovergestelde van homozygote dominant?
- Onderzoekers beschrijven allereerste hybride vogelsoorten uit de Amazone
- Garens bedekt met enzymen kunnen als filters werken

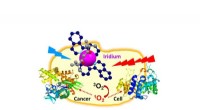
- Kankercellen vernietigd met metaal van de asteroïde die de dinosauriërs heeft gedood
- Nobelprijs Scheikunde:Grote onderscheiding voor moleculaire zaken

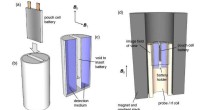
- Chemici ontwikkelen MRI-achtige techniek om te detecteren wat er aan de hand is met batterijen
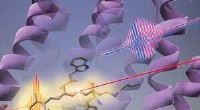
- Eiwitveranderingen gaan vooraf aan foto-isomerisatie van retinale chromofoor
 Wat gebeurt er met het verspillen van persoonlijke beschermingsmiddelen tijdens de coronaviruspandemie?
Wat gebeurt er met het verspillen van persoonlijke beschermingsmiddelen tijdens de coronaviruspandemie? Wat genereert meer elektriciteitswind of zonne -energie?
Wat genereert meer elektriciteitswind of zonne -energie?  Machine learning gebruiken om verslechterde Van Gogh-tekeningen te reconstrueren
Machine learning gebruiken om verslechterde Van Gogh-tekeningen te reconstrueren Hoeveel atomen in ammoniumchloride?
Hoeveel atomen in ammoniumchloride?  Welke persoonlijke eigenschappen hebben paleontoloog nodig?
Welke persoonlijke eigenschappen hebben paleontoloog nodig?  Speelt de zon een rol bij verwering?
Speelt de zon een rol bij verwering?  We hebben een miljoen voorheen onontdekte sterrenstelsels buiten de Melkweg in kaart gebracht. Volg hier de virtuele tour.
We hebben een miljoen voorheen onontdekte sterrenstelsels buiten de Melkweg in kaart gebracht. Volg hier de virtuele tour. Nieuwe coating kan grote gevolgen hebben voor lithiumbatterijen
Nieuwe coating kan grote gevolgen hebben voor lithiumbatterijen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

