
Wetenschap
Wat is de oxidatietoestand van een element?
Hier is een uitsplitsing:
* elektronegativiteit: Dit is het vermogen van een atoom om elektronen naar zichzelf aan te trekken in een chemische binding.
* chemische bindingen: Atomen delen of brengen elektronen over om bindingen te vormen.
* Oxidatietoestand: Het is toegewezen aan een atoom in een molecuul of ion.
* Een positieve oxidatietoestand betekent dat het atoom elektronen heeft verloren (het is geoxideerd).
* Een negatieve oxidatietoestand betekent dat het atoom elektronen heeft gewonnen (het is verminderd).
* Een oxidatietoestand van nul betekent dat het atoom geen elektronen heeft verloren of gewonnen.
Regels voor het bepalen van oxidatietoestanden:
1. Gratis elementen: De oxidatietoestand van een atoom in zijn elementaire vorm is altijd 0. (bijv. NA, O2, Cl2)
2. Monatomische ionen: De oxidatietoestand is gelijk aan de lading van het ion. (bijv. Na + =+1, o2- =-2)
3. Fluor: Fluor heeft altijd een oxidatietoestand van -1.
4. zuurstof: Zuurstof heeft meestal een oxidatietoestand van -2, behalve in peroxiden (zoals H2O2) waar het -1 is, en in verbindingen met fluor waar het positief is.
5. waterstof: Waterstof heeft meestal een oxidatietoestand van +1, behalve in metaalhydriden (zoals NAH) waar het -1 is.
6. De som van oxidatietoestanden in een neutraal molecuul is nul.
7. De som van oxidatietoestanden in een polyatomisch ion is gelijk aan de lading van het ion.
Voorbeeld:
Laten we water nemen (H2O):
* Zuurstof (O) heeft een oxidatietoestand van -2 (regel 4).
* Waterstof (H) heeft een oxidatietoestand van +1 (regel 5).
* Omdat er twee waterstofatomen zijn, is de totale oxidatietoestand voor waterstof +2.
* De som van de oxidatietoestanden (+2 - 2) is gelijk aan nul, wat bevestigt dat het molecuul neutraal is.
Belang van oxidatietoestanden:
* Voorspelling van chemische reacties: Het kennen van de oxidatietoestanden van elementen helpt om te voorspellen of er waarschijnlijk een reactie zal optreden en welke producten kunnen vormen.
* Balancing chemische vergelijkingen: Oxidatietoestanden helpen bij het in evenwicht brengen van redoxreacties (reacties met elektronenoverdracht).
* Inzicht in chemische binding: Oxidatietoestanden geven inzicht in de aard van chemische bindingen en de verdeling van elektronen in moleculen.
Laat het me weten als je meer voorbeelden wilt doorlopen!
 Wat is de definitie van een ethgnesuoereo-mengsel dat verschillende materialen bevat die gemakkelijk van elkaar te onderscheiden zijn?
Wat is de definitie van een ethgnesuoereo-mengsel dat verschillende materialen bevat die gemakkelijk van elkaar te onderscheiden zijn?  Hoe zal N-propylbromide omzetten in iso-propylbromide?
Hoe zal N-propylbromide omzetten in iso-propylbromide?  Hoe noem je een hydraat als het zijn watermoeculen heeft verloren?
Hoe noem je een hydraat als het zijn watermoeculen heeft verloren?  Is magneet een elementenmengsel of verbinding?
Is magneet een elementenmengsel of verbinding?  Een nieuw ontwerp voor flowbatterijen
Een nieuw ontwerp voor flowbatterijen
Hoofdlijnen
- Een microfluïdisch systeem met celscheidende krachten kan ontrafelen hoe nieuwe ziekteverwekkers aanvallen
- Chinese wetenschappers onthullen een nieuwe signaalroute voor koude tolerantie in rijst
- Wat zijn drie locaties in het menselijk lichaam waar twee systemen contact maken?
- Hoe zou u de Calvin -cyclus beschrijven?
- Precies weten wat genen zeggen – en waar
- Afrikaanse gewassen bieden een voedzame, glutenvrije oplossing
- Wat is de afgifte van groot molecuul uit een cel met behulp van blaasjes?
- Cat Chromosome-informatie
- Waar zit zoutzuur in de voedselmassa?
- Een nieuw soort plastic dat zijn oorspronkelijke eigenschappen behoudt bij recycling

- Bepalen wat bindt aan slijm
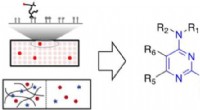
- Een baanbrekende ontdekking in de conversie van koolstofafvang voor de productie van ethyleen

- Een volledig organische protonenbatterij die wordt geactiveerd voor duurzame energieopslag
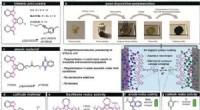
- Nano-roest:slim additief voor autonome temperatuurregeling

 Hoe is olie beter dan andere energiebronnen?
Hoe is olie beter dan andere energiebronnen?  Wetenschappers synthetiseren onderzoek, model voor kustbepantsering evalueren
Wetenschappers synthetiseren onderzoek, model voor kustbepantsering evalueren Wanneer deeltjes gewelddadig botsen, welke staat is dit?
Wanneer deeltjes gewelddadig botsen, welke staat is dit?  Kunnen wetenschappers een ster op aarde maken?
Kunnen wetenschappers een ster op aarde maken?  Wat is de moleculaire vorm van ALCL6?
Wat is de moleculaire vorm van ALCL6?  Door het trainen van hersenprocessen wordt het lezen efficiënter
Door het trainen van hersenprocessen wordt het lezen efficiënter  Dynamisch energiebeheersysteem voor het MKB
Dynamisch energiebeheersysteem voor het MKB Hoe een hoek te meten met een hoekmeter
Hoe een hoek te meten met een hoekmeter
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

