
Wetenschap
Wat is de oxidatietoestand van elk element in SO3-2?
Regels om te onthouden:
* de oxidatietoestand van de zuurstof is typisch -2 , behalve in peroxiden (waar het -1 is) en wanneer gebonden aan fluor (waar het positief is).
* De som van de oxidatietoestanden in een polyatomisch ion moet gelijk zijn aan de lading van het ion.
De regels toepassen:
1. zuurstof: We hebben drie zuurstofatomen, elk met een oxidatietoestand van -2. Dit draagt in totaal 3 * (-2) =-6 bij aan de totale lading.
2. zwavel: Aangezien het sulfietion (SO₃⁻²) een lading van -2 heeft en de zuurstofatomen bij -6 bijdragen, moet het zwavelatoom een oxidatietoestand van +4 hebben om het in evenwicht te brengen.
Daarom zijn de oxidatietoestanden:
* zwavel (s):+4
* Oxygen (O):-2
 Hoe berekent u standaard enthalpie van neutralisatiehydrochloorzuur en natriumchloride met behulp van CRC Handbook Chemistry Physics?
Hoe berekent u standaard enthalpie van neutralisatiehydrochloorzuur en natriumchloride met behulp van CRC Handbook Chemistry Physics?  Wat combineert met zuurstof?
Wat combineert met zuurstof?  Team ontdekt dubbele helixstructuur in synthetisch macromolecuul
Team ontdekt dubbele helixstructuur in synthetisch macromolecuul Nieuwe berekeningsaanpak maakt nauwkeurigere voorspellingen mogelijk van hoe atomen ioniseren wanneer ze worden beïnvloed door hoogenergetische elektronen
Nieuwe berekeningsaanpak maakt nauwkeurigere voorspellingen mogelijk van hoe atomen ioniseren wanneer ze worden beïnvloed door hoogenergetische elektronen  Hoe kan een leerling een magneet gebruiken om aan te geven dat het combineren van ijzer en zwavel een mengsel van en fysieke verandering teweegbrengt?
Hoe kan een leerling een magneet gebruiken om aan te geven dat het combineren van ijzer en zwavel een mengsel van en fysieke verandering teweegbrengt?
Hoofdlijnen
- Hoe concurrentie tussen soorten leidde tot een ‘bizar’ patroon in onze eigen evolutionaire stamboom
- Wijst het ontbrekende gen op het nachtelijke bestaan van vroege zoogdieren?
- Waar kwam het woord zoogdier vandaan?
- Wat zijn de samenstellende elementen van eiwitten?
- Waarom zijn sommige E. coli dodelijk terwijl andere vreedzaam in ons lichaam leven?
- Kun je me de soorten en functies van plantenweefsels van dierenweefsels geven?
- Licht werpend op hoe bacteriën met elkaar omgaan
- Studie vindt antimicrobiële resistentie in bodems in heel Schotland
- Wat zijn de 10 wetenschapstakken?
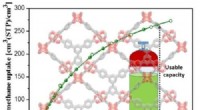
- Chemici ID katalytische sleutel voor het omzetten van CO2 in methanol
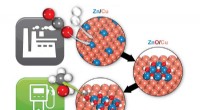
- Aardgas kan de kloof overbruggen van benzine naar elektrische voertuigen, dankzij metaal-organische raamwerken
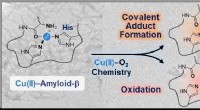
- Coördinatiechemie en de ziekte van Alzheimer
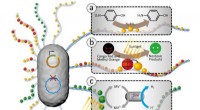
- Geconstrueerde bacteriële biofilms die nanodeeltjes immobiliseren, maken diverse katalytische toepassingen mogelijk
- Beeldvorming van chemische kinetiek op vloeistof-vloeistof-interfaces
 Wat betekent opgeslagen energie?
Wat betekent opgeslagen energie?  Wat is Dukono -plaattektoniek?
Wat is Dukono -plaattektoniek?  Gemodificeerde zijden doek houdt de huid koeler dan katoen
Gemodificeerde zijden doek houdt de huid koeler dan katoen  Wat zijn de belangrijkste vier microben?
Wat zijn de belangrijkste vier microben?  Welk lichaamsdeel is als de mitochondria?
Welk lichaamsdeel is als de mitochondria?  Wat zijn drie verschillende dingen die gebeuren met de zonne -energie die de aarde ontvangt?
Wat zijn drie verschillende dingen die gebeuren met de zonne -energie die de aarde ontvangt?  Bezos biedt NASA een korting van $ 2 miljard voor Blue Origin Moon-lander
Bezos biedt NASA een korting van $ 2 miljard voor Blue Origin Moon-lander Is het verbranden van steenkool een oorzaak zure neerslag?
Is het verbranden van steenkool een oorzaak zure neerslag?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

