
Wetenschap
Wat is de relatie tussen het aantal valentie -elektronen en geleidbaarheid een bepaald element?
1. Metalen:
* Hoge geleidbaarheid: Metalen hebben over het algemeen 1-3 valentie-elektronen . Deze elektronen zijn losjes gebonden en kunnen vrij door het metalen rooster bewegen. Dit vrije verkeer van elektronen is wat een hoge elektrische en thermische geleidbaarheid mogelijk maakt.
* Voorbeelden: Koper (1 valentie -elektron), zilver (1 valentie -elektron), goud (1 valentie -elektron).
2. Niet-metalen:
* Lage geleidbaarheid: Niet-metalen hebben meestal 4-8 valentie-elektronen . Deze elektronen zijn strak gebonden aan het atoom en worden niet gemakkelijk vrijgemaakt voor geleiding.
* Voorbeelden: Zwavel (6 valentie -elektronen), chloor (7 valentie -elektronen), zuurstof (6 valentie -elektronen).
3. Uitzonderingen:
* halfgeleiders: Elementen zoals silicium en germanium hebben 4 valentie -elektronen . Het zijn noch goede dirigenten noch goede isolatoren. Ze vertonen tussenliggende geleidbaarheid, die kan worden gemanipuleerd door te doperen met andere elementen.
* metalloïden: Deze elementen (zoals arseen en antimoon) liggen op de grens tussen metalen en niet-metalen. Ze kunnen variabele geleidbaarheid vertonen, afhankelijk van factoren zoals temperatuur en onzuiverheden.
Daarom is het aantal valentie -elektronen niet de enige bepalende factor voor geleidbaarheid. Andere factoren die de geleidbaarheid beïnvloeden, zijn onder meer:
* bindtype: Metallic binding zorgt voor vrije elektronenbeweging.
* kristalstructuur: De opstelling van atomen kan de elektronenmobiliteit beïnvloeden.
* Temperatuur: Verhoogde temperatuur kan de geleidbaarheid in metalen verlagen en de geleidbaarheid bij halfgeleiders verhogen.
* onzuiverheden: De aanwezigheid van onzuiverheden kan de geleidbaarheid aanzienlijk veranderen.
Samenvattend:
Het aantal valentie -elektronen geeft een algemene indicatie van de geleidbaarheid van een element, maar het is geen definitieve factor. Het is cruciaal om andere factoren te overwegen om de geleidbaarheid van een element te begrijpen.
 Armoede, ethiek en discriminatie:hoe cultuur speelt in cognitief onderzoek
Armoede, ethiek en discriminatie:hoe cultuur speelt in cognitief onderzoek  Matchmaking voor zoete aardappel? Het is ingewikkeld
Matchmaking voor zoete aardappel? Het is ingewikkeld Wat is de betekenis van het verdeel?
Wat is de betekenis van het verdeel?  Top 10 inzichten in klimaatwetenschap in 2020 geselecteerd door 57 toonaangevende wereldwijde onderzoekers
Top 10 inzichten in klimaatwetenschap in 2020 geselecteerd door 57 toonaangevende wereldwijde onderzoekers Typen chlorofyl aanwezig in Algae
Typen chlorofyl aanwezig in Algae
Hoofdlijnen
- Is parasitisme een vorm van symbiose?
- Wat voor soort wetenschapper die dingen in groepen plaatst?
- Verschil tussen menselijke en protistische huidcellen?
- Wat zijn twee algemene categorieën die er toe doen, kunnen worden geclassificeerd?
- Welk type weefsel vormt het buitenste oppervlaktelichaam?
- Onderzoekers passen gist aan om te laten zien hoe planten reageren op een belangrijk hormoon
- Waarom is celdifferentiatie belangrijk?
- Welke wetenschapper bestudeert alle aspecten van de samenleving en de interpersoonlijke relaties mensen in die samenleving?
- Simpele vetten en aminozuren om uit te leggen hoe het leven begon
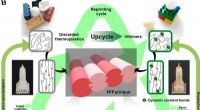
- Upcycling van kunststoffen door dynamische cross-linking
- Het onthullen van de nanostructuur van hout zou kunnen helpen de hoogtelimieten voor houten wolkenkrabbers te verhogen

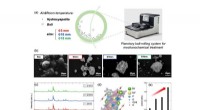
- Nieuwe machine learning-techniek analyseert snel nanomedicijnen voor immunotherapie bij kanker
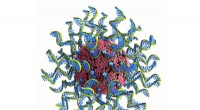
- Botdiep:Mineraal gevonden in menselijk bot kan helpen bij het bestrijden van giftige organische stoffen
- Onderzoekers maken de eerste rietjes met polyhydroxyalkanoaat (PHA) plastic

 Wat eet Minnows?
Wat eet Minnows?  Veroorzaakt de afstand tot de zon seizoenen?
Veroorzaakt de afstand tot de zon seizoenen?  Wat is een structuur in de kern waar RNA is getranscribeerd?
Wat is een structuur in de kern waar RNA is getranscribeerd?  Nanobuisjes van titaniumoxide maken goedkope laserondersteunde fotoporatie mogelijk
Nanobuisjes van titaniumoxide maken goedkope laserondersteunde fotoporatie mogelijk Wat is de chemische formule C2H5BR?
Wat is de chemische formule C2H5BR?  Harde Brexit kan ertoe leiden dat Philips de Britse fabriek verlaat:CEO
Harde Brexit kan ertoe leiden dat Philips de Britse fabriek verlaat:CEO Isopropanol Alcohol Vs. Isopropylalcohol
Isopropanol Alcohol Vs. Isopropylalcohol  Welke taal wordt gebruikt in het binomiale systeem?
Welke taal wordt gebruikt in het binomiale systeem?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

