
Wetenschap
De juiste elektronenstipformule voor waterstofchloride is?
1. Bepaal het aantal valentie -elektronen:
* Waterstof (H) heeft 1 valentie -elektron.
* Chloor (CL) heeft 7 valentie -elektronen.
2. Plaats het minst elektronegatieve atoom in het midden:
* Waterstof is minder elektronegatief dan chloor. Omdat waterstof echter slechts één binding kan vormen, is deze aan de buitenkant.
3. Verbind de atomen met een enkele binding:
* Dit gebruikt twee elektronen, één van elk atoom.
4. Voltooi het octet voor het meer elektronegatieve atoom:
* Chloor heeft nog 6 elektronen nodig om een volledig octet te hebben. We voegen drie eenzame paren (6 stippen) toe rond het chlooratoom.
De elektronenstotformule voor HCl ziet er zo uit:
H:Cl:
::
::
Sleutelpunten:
* De enkele binding tussen H en CL vertegenwoordigt het delen van twee elektronen.
* Chloor heeft een volledig octet (8 elektronen) terwijl waterstof een volledig duet heeft (2 elektronen).
* De Lewis -structuur vertegenwoordigt nauwkeurig de binding in HCl.
 Hoe u algemene geuren kunt uitschakelen en u kunt concentreren op belangrijke geuren
Hoe u algemene geuren kunt uitschakelen en u kunt concentreren op belangrijke geuren  Wat is het smeltpunt en koken van waterstof in graden Celsius?
Wat is het smeltpunt en koken van waterstof in graden Celsius?  Zelfmontage vereist:neutronen onderzoeken nieuw polymeergedrag voor biomedische materialen
Zelfmontage vereist:neutronen onderzoeken nieuw polymeergedrag voor biomedische materialen Kan metaal u beschermen tegen gevaarlijke gassen?
Kan metaal u beschermen tegen gevaarlijke gassen?  Heeft zout invloed op de temperatuur van kokend water?
Heeft zout invloed op de temperatuur van kokend water?
 Een belangrijke scorecard geeft de gezondheid van de Australische omgeving minder dan 1 op 10
Een belangrijke scorecard geeft de gezondheid van de Australische omgeving minder dan 1 op 10 Satelliet ziet tropische cycloon Cilida ten noorden van Mauritius
Satelliet ziet tropische cycloon Cilida ten noorden van Mauritius Filippijnse nederzetting, onder water gezet door een dam, verschijnt weer als gevolg van droogte
Filippijnse nederzetting, onder water gezet door een dam, verschijnt weer als gevolg van droogte  Een stroomgebiedstudie voor het herstel van wetland
Een stroomgebiedstudie voor het herstel van wetland Model onthult de beste aanpak om mensen water te laten besparen in verschillende gebieden
Model onthult de beste aanpak om mensen water te laten besparen in verschillende gebieden
Hoofdlijnen
- Nieuw onderzoek suggereert dat diverse hoofddeksels bij hoefdieren zijn geëvolueerd uit een gemeenschappelijke voorouder
- Waarom zijn we gewelddadig?
- Welk deel van het lichaam verzint eiwitten?
- Onderzoekers ontdekken de echte reden waarom schildpadden schelpen hebben
- Wat is een voorbeeld van hoe wetenschapper gegevens verzamelen?
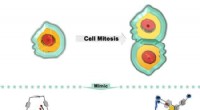
- Identieke cellen gevormd tijdens celdeling?
- Is de oorsprong van gekweekte kumquatsoorten betrokken bij kumquats uit Hong Kong? Waarschijnlijk niet
- Welk soort allel moet een organisme erven voordat een recessieve eigenschap zichtbaar wordt?
- Natuurkundigen modelleren de vouwing van chromosomen en onthullen hoe lussen de ruimtelijke organisatie van het genoom beïnvloeden
- Bio-ingenieurs creëren een weg naar gepersonaliseerde geneeskunde
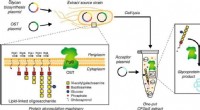
- Elektrische verbetering:ingenieurs versnellen elektronen in halfgeleiders
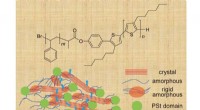
- Steenkool onthult een verfijnde kant:vuile koolstof kan worden gebruikt om een verscheidenheid aan nuttige apparaten te maken

- De oppervlaktechemie van SARS-CoV-2 begrijpen
- Onderzoekers onthullen gastreactiegestuurde kooi aan Siamese tweelingkooi, mitose-achtige gastheertransformatie
 Vliegreizen en klimaat:een potentiële nieuwe feedback?
Vliegreizen en klimaat:een potentiële nieuwe feedback?  Wat is de wetenschap achter Apple Project?
Wat is de wetenschap achter Apple Project?  Van welk type materie is de zon gemaakt?
Van welk type materie is de zon gemaakt?  Mitsubishi A6M Nul
Mitsubishi A6M Nul  Welk mysterie van het universum legt mythe Orion uit?
Welk mysterie van het universum legt mythe Orion uit?  Welke formele lading heeft koolstof?
Welke formele lading heeft koolstof?  Uitvinding van vormveranderend textiel dat alleen wordt aangedreven door lichaamswarmte
Uitvinding van vormveranderend textiel dat alleen wordt aangedreven door lichaamswarmte Wanneer moeten banken schulden najagen? Een nieuwe methode zou hen kunnen helpen beslissen
Wanneer moeten banken schulden najagen? Een nieuwe methode zou hen kunnen helpen beslissen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

