
Wetenschap
Welke van deze Compouts is meer vluchtige aceton methanol 2-butanon T-butylchloride?
Volatiliteit begrijpen
Volatiliteit verwijst naar het gemak waarmee een stof van een vloeistof in een gas verandert (verdampt). Factoren die de volatiliteit beïnvloeden, zijn onder meer:
* intermoleculaire krachten: Zwakkere intermoleculaire krachten (zoals dispersiekrachten in Londen) leiden tot hogere volatiliteit. Sterkere krachten (zoals waterstofbinding) verminderen de volatiliteit.
* Molecuulgewicht: Lichte moleculen hebben zwakkere intermoleculaire krachten en zijn meestal vluchtiger.
Analyse van de verbindingen
Laten we elke verbinding onderzoeken:
* aceton (ch₃coch₃): Heeft dipool-dipool interacties maar geen waterstofbinding.
* methanol (ch₃oh): Vormt sterke waterstofbruggen vanwege de aanwezigheid van de -OH -groep.
* 2-butanone (ch₃ch₂coch₃): Vergelijkbaar met aceton, dipool-dipool interacties maar geen waterstofbinding.
* t-butylchloride (ch₃) ₃ccl: Heeft alleen London Dispersion Forces (zwakste intermoleculaire kracht).
Conclusie
Gebaseerd op de bovenstaande analyse:
* t-butylchloride zal het meest vluchtig zijn omdat het de zwakste intermoleculaire krachten heeft.
* aceton en 2-butanon Zal volatieler zijn dan methanol omdat ze geen waterstofbinding hebben.
Daarom is t-butylchloride de meest vluchtige verbinding tussen de gegeven opties.
 Waarom commercialisering van koolstofafvang en -vastlegging is mislukt en hoe het kan werken?
Waarom commercialisering van koolstofafvang en -vastlegging is mislukt en hoe het kan werken? Welke filosoof gelooft dat de staat van de natuur een oorlog is, allemaal tegen iedereen?
Welke filosoof gelooft dat de staat van de natuur een oorlog is, allemaal tegen iedereen?  Leren hoe de natuur water splitst
Leren hoe de natuur water splitst  Proeven aan de gang voor nieuw kant-en-klaarmaaltijdpakket op basis van vezels
Proeven aan de gang voor nieuw kant-en-klaarmaaltijdpakket op basis van vezels Wat heeft grondwater te maken met meeralgenbloei?
Wat heeft grondwater te maken met meeralgenbloei?
Hoofdlijnen
- Is het waar dat Chromatine de instructies bevat voor directe functies van een cel?
- Kunnen eiwitten in verschillende groepen worden verdeeld?
- Hebben wetenschappelijke modellen twee basistypen?
- Onderzoek naar stekelbaarsvissen laat zien dat bij aanpassing aan nieuwe omgevingen veel genen betrokken zijn
- Wat produceert haploïde cellen?
- Hoe bidsprinkhaangarnalen vele vormen ontwikkelden met dezelfde krachtige stoot
- Hoe elektroconvulsietherapie werkt
- Zullen mutaties die zich in lichaamscellen voordoen altijd levensbedreigend zijn voor het organisme?
- Ambien
- Energie opvangen uit zonlicht met kleurstoffen geïnspireerd door de natuur

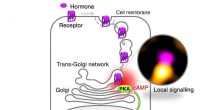
- Hoe receptoren voor medicijnen in cellen werken
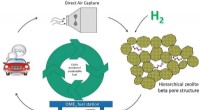
- De weg naar het bereiken van netto nul vloeibare brandstof
- Verschillende technieken nodig om vingerafdrukken op nieuwe bankbiljetten te detecteren

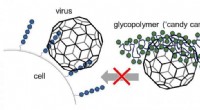
- Kunstmatige zuurstokken om virussen te blokkeren
 Ongebruikelijke sterrenstelsels tarten theorie van donkere materie
Ongebruikelijke sterrenstelsels tarten theorie van donkere materie Methaanpluim boven gasbronnen in New Mexico gezien vanuit de ruimte
Methaanpluim boven gasbronnen in New Mexico gezien vanuit de ruimte De dikte berekenen met Area & Volume
De dikte berekenen met Area & Volume Hoe veilig is reizen naar Mars
Hoe veilig is reizen naar Mars  Wat is het verschil tussen fyische en chemische veranderingen?
Wat is het verschil tussen fyische en chemische veranderingen?  Het tijdperk van planeetvorming, keer twintig
Het tijdperk van planeetvorming, keer twintig Wat doet de zon voor uw zonnestelsel?
Wat doet de zon voor uw zonnestelsel?  Hoe nanodeeltjes elektronen weggeven
Hoe nanodeeltjes elektronen weggeven
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

