
Wetenschap
Welke lading zou een fluor -ion waarschijnlijk hebben?
Een fluor-ion zou hoogstwaarschijnlijk een -1 lading hebben .
Dit is waarom:
* Fluor's Electron Configuration: Fluor heeft 9 elektronen, met de elektronische configuratie 2, 7. Dit betekent dat het 7 elektronen heeft in de buitenste schaal (valentieschaal).
* De octetregel: Atomen hebben de neiging om elektronen te winnen, verliezen of delen om een stabiele configuratie te bereiken met 8 elektronen in hun buitenste schaal (de octetregel).
* een elektron winnen: Om fluor een octet te bereiken, is het gemakkelijker om één elektron te krijgen. Dit resulteert in een volledige buitenste schaal met 8 elektronen en een netto lading van -1.
Daarom wordt een fluorion typisch weergegeven als F⁻.
 Eenvoudige watertest kan verlammende botziekte voorkomen
Eenvoudige watertest kan verlammende botziekte voorkomen Wat is de ene substantie die zo gelijkmatig in een andere wordt verspreid dat je de twee stoffen niet uit elkaar kunt vertellen?
Wat is de ene substantie die zo gelijkmatig in een andere wordt verspreid dat je de twee stoffen niet uit elkaar kunt vertellen?  Welke intermoleculaire kracht zou het kookpunt het minst beïnvloeden?
Welke intermoleculaire kracht zou het kookpunt het minst beïnvloeden?  Nieuw nanoporeus metaalschuim gebruikt zonlicht om water op te ruimen
Nieuw nanoporeus metaalschuim gebruikt zonlicht om water op te ruimen Heeft Sprite er koolstofdioxide in?
Heeft Sprite er koolstofdioxide in?
 Energieagentschap:stop nieuwe investeringen in de levering van fossiele brandstoffen
Energieagentschap:stop nieuwe investeringen in de levering van fossiele brandstoffen Bergbossen hebben geen mensen nodig, maar we hebben ze wel nodig
Bergbossen hebben geen mensen nodig, maar we hebben ze wel nodig Dit is wat natuurbeschermers zeggen dat waarschijnlijk de mysterieuze walvissterfte langs de oostkust veroorzaakt
Dit is wat natuurbeschermers zeggen dat waarschijnlijk de mysterieuze walvissterfte langs de oostkust veroorzaakt  Mijlenlange olieramp in de Golf nadat Ida onderzoek heeft gedaan door kustwacht
Mijlenlange olieramp in de Golf nadat Ida onderzoek heeft gedaan door kustwacht Hoe beïnvloedt fotosynthese de atmosfeer van de planeet?
Hoe beïnvloedt fotosynthese de atmosfeer van de planeet?
Hoofdlijnen
- El Nino in de Stille Oceaan heeft invloed op dolfijnen in West-Australië
- Hoe reproduceren virussen?
- Wie stelde het idee van overleven die fittest is een theorie -evolutie voor?
- Wat is een vorm van endocytose waarbij transportvloeistofdruppeltjes of kleine deeltjes betrokken zijn?
- Wat is ablatie?
- Wat is een voorbeeld van open populatie in de wetenschap?
- Is een cattail eencellig of meercellulair?
- Wat is het type wetenschap met voorlopige explantatie?
- Wat is de ploid van organismen met twee sets chromosomen?
- Interactie tussen jodonium en zilverkation voor het eerst aangetoond
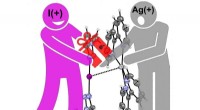
- Forensisch onderzoek bewijst dat textielvezels kunnen worden overgedragen tussen kleding zonder contact

- Tweaks achter de wedergeboorte van bijna afgedankte organische zonnetechnologieën

- Lignine gebruiken om fossiele materialen te vervangen

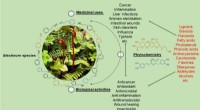
- Onderzoekers beoordelen gebruik, fytochemie en farmacologische eigenschappen van het geslacht Blechnum
 Wat is de som van alle chemische processen die plaatsvinden in een organisme?
Wat is de som van alle chemische processen die plaatsvinden in een organisme?  Wat is de volledige vorm van SI -eenheid in de wetenschap?
Wat is de volledige vorm van SI -eenheid in de wetenschap?  Welk veronderstelde ESP -vaardigheid omvat het kunnen zien van iets dat niet fysiek aanwezig is door een ander object aan te raken?
Welk veronderstelde ESP -vaardigheid omvat het kunnen zien van iets dat niet fysiek aanwezig is door een ander object aan te raken?  Hoe Celsius converteren naar Kelvin
Hoe Celsius converteren naar Kelvin Welke twee variabelen worden gebruikt om sterren te classificeren?
Welke twee variabelen worden gebruikt om sterren te classificeren?  Sociale media gebruiken om de woede van terreuraanslagen te verzwakken
Sociale media gebruiken om de woede van terreuraanslagen te verzwakken Natuurkundigen simuleren topologische materialen met ultrakoude atomen
Natuurkundigen simuleren topologische materialen met ultrakoude atomen De Mars Sample Return-missie heeft een wankele toekomst en NASA doet een beroep op particuliere bedrijven voor ondersteuning
De Mars Sample Return-missie heeft een wankele toekomst en NASA doet een beroep op particuliere bedrijven voor ondersteuning
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

