
Wetenschap
Vergelijking voor de reactie tussen zink en koperchloride?
Zn (s) + CUCL₂ (aq) → ZnCl₂ (aq) + cu (s)
Verklaring:
* Zn (s): Zink is de vaste reactant, voorgesteld door (s).
* cucl₂ (aq): Koperchloride is de waterige reactant (opgelost in water), weergegeven door (aq).
* ZnCl₂ (aq): Zinkchloride is het waterige product gevormd, vertegenwoordigd door (aq).
* cu (s): Koper is het solide product, vertegenwoordigd door (s).
Wat gebeurt er:
Zink is reactiever dan koper. Dit betekent dat zink koper uit zijn verbinding kan verplaatsen. In de reactie verliezen zinkatomen elektronen (oxidatie) en worden zinkionen (Zn²⁺), die vervolgens combineren met chloride -ionen (CL⁻) om zinkchloride te vormen. Tegelijkertijd worden koperionen (Cu²⁺) van koperchloride -elektronen (reductie) en worden koperatomen, die als een vaste stof worden afgezet.
Observaties:
* U zult een roodbruine vaste (koper) die vormt op het oppervlak van het zink waarnemen.
* De oplossing kan van kleur veranderen, afhankelijk van de concentratie koperchloride en de hoeveelheid gevormde koper.
 Het synthetiseren van arylsulfiden uit niet-ruikende, niet-toxische verbindingen
Het synthetiseren van arylsulfiden uit niet-ruikende, niet-toxische verbindingen Heeft een ionenatoom of molecuul elektrische lading?
Heeft een ionenatoom of molecuul elektrische lading?  Hoe verdun je 10 volume peroxide tot 5 peroxide?
Hoe verdun je 10 volume peroxide tot 5 peroxide?  Welke temperatuur smelt kristallen in Fahrenheit?
Welke temperatuur smelt kristallen in Fahrenheit?  Een munt van 6,80 g wordt opgelost in salpeterzuur en 6,21 g AgCl wordt neergeslagen door de toevoeging van een overmaat natriumchloride. Bereken het percentage zilveren munt?
Een munt van 6,80 g wordt opgelost in salpeterzuur en 6,21 g AgCl wordt neergeslagen door de toevoeging van een overmaat natriumchloride. Bereken het percentage zilveren munt?
 Wat is goed aan de moesson?
Wat is goed aan de moesson?  Kwetsbare gemeenschappen lopen een groter risico op sociaal-economisch onrecht als gevolg van overstromingsgevaar
Kwetsbare gemeenschappen lopen een groter risico op sociaal-economisch onrecht als gevolg van overstromingsgevaar Soorten duizendpoten in Californië
Soorten duizendpoten in Californië  Opinie:het is onzin om te zeggen dat fracking veilig kan worden gemaakt, welke richtlijnen we ook bedenken
Opinie:het is onzin om te zeggen dat fracking veilig kan worden gemaakt, welke richtlijnen we ook bedenken Leer van Europese autofabrikanten stimuleert ontbossing:NGO
Leer van Europese autofabrikanten stimuleert ontbossing:NGO
Hoofdlijnen
- Hoe kun je de kans vergroten dat een groente zijn maximale genetische potentieel bereikt?
- Waar komen Maryland-krabben vandaan? Onderzoekers gebruiken een virus, oceaanstromingskaarten en meer om dit te achterhalen
- Wat betekent ##### in Excel?
- Onder geraniums zwaaien petunias of fuchsias die de moeilijkste bloem is?
- Ricine alleen dodelijk in combinatie met suiker
- Voor melkveehouders, waar blijft de tijd?
- Proteomische analyse laat zien hoe fosfiet bijdraagt aan de strijd tegen chemisch resistente afsterving
- Nieuw gevonden tandring onthult hoe gemeenschappelijke voorouder-ruiende dieren eruit zagen
- De geleidbaarheid van zenuwcellen in het centrale zenuwstelsel
- Structuur van de moleculaire machine die het koolhydraat- en lipidenmetabolisme met elkaar verbindt
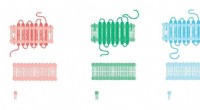
- Moleculair dunne interface tussen polymeren voor efficiënt koolstofdioxide-opvangmembraan

- Chemici nemen de plek waar water en lucht samenkomen onder de loep
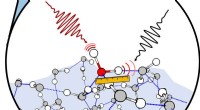
- Een nieuwe tool voor het beheersen van reacties in microrobots en microreactoren

- Proton vaste oxide elektrolytische cel vergemakkelijkt niet-geoxideerde dehydrogenering van ethaan

 Wat is het principe dat betrokken is bij de gewijzigde Brontrager -test?
Wat is het principe dat betrokken is bij de gewijzigde Brontrager -test?  Regenbuien maken binnen enkele dagen een einde aan de bosbranden in Australië
Regenbuien maken binnen enkele dagen een einde aan de bosbranden in Australië YouTube verbiedt haatdragende, supremacistische video's
YouTube verbiedt haatdragende, supremacistische video's Onderzoekers bulldozeren de woestijn om te leren hoe zandduinen ontstaan
Onderzoekers bulldozeren de woestijn om te leren hoe zandduinen ontstaan  Wat is de downhill -beweging van rots of bodem?
Wat is de downhill -beweging van rots of bodem?  Leg uit hoe zwaardere elementen worden gevormd uit waterstof in de kern van een ster?
Leg uit hoe zwaardere elementen worden gevormd uit waterstof in de kern van een ster?  Waarom zou je erom geven dat de natuurlijke vegetatie verandert?
Waarom zou je erom geven dat de natuurlijke vegetatie verandert?  Heeft Kepler ideale SETI-doelplaneten gevonden?
Heeft Kepler ideale SETI-doelplaneten gevonden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

