
Wetenschap
Wat wordt geproduceerd bij de positieve elektrode van elektrolyse gesmolten loodbromide?
Dit is waarom:
* elektrolyse: Dit proces gebruikt een elektrische stroom om een niet-spontane chemische reactie aan te sturen.
* gesmolten loodbromide: In zijn gesmolten toestand dissocieert loodbromide in lood (II) ionen (Pb²⁺) en bromide -ionen (Br⁻).
* anode: De positieve elektrode trekt negatief geladen ionen aan.
* reactie op de anode: Bromide -ionen (Br⁻) verliezen elektronen en worden broomgas (Br₂), die wordt vrijgegeven bij de anode. De reactie is:
2BR⁻ → Br₂ + 2e⁻
* Gelijktijdige reactie: Bij de kathode (negatieve elektrode) krijgen lead (II) ionen (Pb²⁺) elektronen en worden loodmetaal (PB). De reactie is:
Pb²⁺ + 2e⁻ → pb
Daarom is de positieve elektrode (anode) waar broomgas wordt geproduceerd, maar het loodmetaal wordt geproduceerd bij de negatieve elektrode (kathode).
 Onderzoekers overwinnen uitdagingen om nieuwe tyfoonwaarnemingen te verzamelen
Onderzoekers overwinnen uitdagingen om nieuwe tyfoonwaarnemingen te verzamelen Roze kwarts Betekenis:een blik op de echte liefdessteen
Roze kwarts Betekenis:een blik op de echte liefdessteen  Welke stad in Florida heeft een Seaquarium en Serpentarium Monkey Jungle?
Welke stad in Florida heeft een Seaquarium en Serpentarium Monkey Jungle?  Wat zijn de planten van de grondlaag?
Wat zijn de planten van de grondlaag?  Doorbraak in debat over recente toename methaan in de atmosfeer
Doorbraak in debat over recente toename methaan in de atmosfeer
Hoofdlijnen
- Wat is de naam voor een plantarts?
- Waarom bestuderen mensen mariene biologie?
- Wat beschrijft het beste waar cellulaire ademhaling?
- Hoe transhumanisme werkt
- Hoe de hersenen geuren buitensluiten
- Dierenartsen werken samen met vissers om de gezondheid van per ongeluk gevangen zeeschildpadden te evalueren
- Zijn er 705 ribosomen in mitochondria?
- Wat zijn de eigenschappen van kernen?
- Waarom is het belangrijk om lichaamsvet onder controle te houden bij mensen?
- Eenvoudige arseensensor kan levens redden
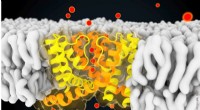
- Structurele en dynamische verschillen tussen selectieve en niet-selectieve ionkanalen
- Prominente academici pleiten voor meer wetenschap in forensische wetenschap

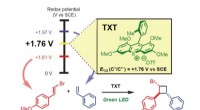
- Licht schijnt op chemische productiemethode
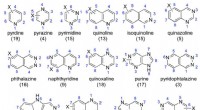
- Naar een beter begrip van structuur-metabolismerelaties in humaan aldehydeoxidase (update)
 Wat zijn de gevaren van methaangas?
Wat zijn de gevaren van methaangas?  3D-printen creëert superzachte structuren die hersenen en longen nabootsen
3D-printen creëert superzachte structuren die hersenen en longen nabootsen Wat gebeurt er als een atoom dat een elektron heeft verloren, in contact komt met een elektron en het heeft gewonnen?
Wat gebeurt er als een atoom dat een elektron heeft verloren, in contact komt met een elektron en het heeft gewonnen?  Is het smelten van ijs in limonade een chemische verandering?
Is het smelten van ijs in limonade een chemische verandering?  Hoe slimme luiers kunnen helpen bij het ontwikkelen van nieuwe wapens in de strijd tegen bacteriën
Hoe slimme luiers kunnen helpen bij het ontwikkelen van nieuwe wapens in de strijd tegen bacteriën  Kan machine learning sneller en goedkoper kritische marktinzichten opleveren over de behoeften van de consument?
Kan machine learning sneller en goedkoper kritische marktinzichten opleveren over de behoeften van de consument? Nanofluïdische multitool scheidt en maten nanodeeltjes
Nanofluïdische multitool scheidt en maten nanodeeltjes Materiaaltheorie combineert kracht, stijfheid en taaiheid van composieten in één ontwerpkaart
Materiaaltheorie combineert kracht, stijfheid en taaiheid van composieten in één ontwerpkaart
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

