
Wetenschap
Hoeveel bindingen worden in neutrale moleculen vaak gevormd door stikstof en afzonderlijk zuurstof?
* stikstof (n): Stikstof vormt meestal drie covalente bindingen . Dit komt omdat het vijf valentie -elektronen heeft en er nog drie nodig heeft om een stabiele octetconfiguratie te bereiken. Voorbeelden zijn ammoniak (NH3) en stikstofgas (N2).
* zuurstof (O): Zuurstof vormt meestal twee covalente bindingen . Het heeft zes valentie -elektronen en heeft er nog twee nodig om zijn octet te voltooien. Voorbeelden zijn water (H2O) en zuurstofgas (O2).
Belangrijke opmerking: Hoewel dit de meest voorkomende bindingspatronen zijn, zijn er enkele uitzonderingen, zoals de vorming van stikstofoxiden (NOx) waar stikstof verschillende aantallen bindingen kan vormen.
 Selectieve oplossing van elementair goud uit multimetaalbronnen in organische oplossingen
Selectieve oplossing van elementair goud uit multimetaalbronnen in organische oplossingen Kunnen kritische metalen voor hernieuwbare energieproducten worden gevonden in bestaande mijnen? Nieuw onderzoek zegt ja
Kunnen kritische metalen voor hernieuwbare energieproducten worden gevonden in bestaande mijnen? Nieuw onderzoek zegt ja  Produceert uw lichaam een bepaalde chemische stof als u verdrietig bent?
Produceert uw lichaam een bepaalde chemische stof als u verdrietig bent?  Zijn de meeste stoffen om ons heen puur oa mengsel?
Zijn de meeste stoffen om ons heen puur oa mengsel?  Hoeveel volle elektronen heeft zwavel?
Hoeveel volle elektronen heeft zwavel?
Hoofdlijnen
- Geit sterft voor het eerst in de VS aan vogelgriep, zeggen ambtenaren van Minnesota:waarom het 'significant' is
- Wat zijn alle labeldelen van chromosoom?
- Bacterieel model helpt onthullen hoe ons lichaam bevolkingsexplosies – en kanker – voorkomt
- Wat is een ander woord voor wetenschapper?
- Angst voor de dood is van invloed op de manier waarop we stemmen
- Nieuwe techniek helpt te ontdekken of bacteriën die meningitis veroorzaken resistent zijn tegen antibiotica
- Synthetische seks in gist belooft veiligere medicijnen voor mensen
- Wat is cyberchondrie?
- Beschrijf de waarschijnlijke effecten op een ecosysteem als alle ontleders zouden sterven?
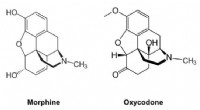
- Minder verslavende opioïden ontwerpen door middel van chemie
- Peulvruchten opgewekt als nieuwe studie geheimen onthult van de plant die mensen kalm houdt

- Eenvoudig proces haalt waardevol magnesiumzout uit zeewater

- Nieuw tandheelkundig materiaal is bestand tegen tandplak en doodt microben, tandheelkundig team vindt

- Groot oppervlak geeft superkrachten aan ultraporeuze materialen

 Achter het dode waterfenomeen
Achter het dode waterfenomeen Hoeveel liter zijn gelijk aan 3,36 Amerikaanse gallons?
Hoeveel liter zijn gelijk aan 3,36 Amerikaanse gallons?  Wat gebeurt er als de zon verdwijnt?
Wat gebeurt er als de zon verdwijnt?  Chiro-optische kracht waargenomen op nanoschaal
Chiro-optische kracht waargenomen op nanoschaal  Wat is sterke basisaniline of o-nitroaniline?
Wat is sterke basisaniline of o-nitroaniline?  Kan Mars 's nachts worden gezien zonder een telescoop?
Kan Mars 's nachts worden gezien zonder een telescoop?  Totale zonsverduistering 1e in 99 jaar om de breedte van de VS te vegen
Totale zonsverduistering 1e in 99 jaar om de breedte van de VS te vegen Wat zijn twee bronnen van verbranding?
Wat zijn twee bronnen van verbranding?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

