
Wetenschap
Wanneer een ion en atoom iso -elektronisch zijn?
Hier is een uitsplitsing:
* iso -elektronisch: De term betekent letterlijk "gelijke elektronen".
* ion: Een atoom dat elektronen heeft gewonnen of verloren, wat resulteert in een netto positieve of negatieve lading.
* atoom: Een neutrale entiteit met een gelijk aantal protonen en elektronen.
Voorbeeld:
* Oxygenatoom (O): Heeft 8 elektronen (8 protonen).
* fluoride -ion (f⁻): Heeft 10 elektronen (9 protonen). Het kreeg één elektron om negatief geladen te worden.
Zowel zuurstof als het fluoride -ion hebben 10 elektronen, waardoor ze iso -elektronisch zijn.
Sleutelpunten:
* iso -elektronische soorten kunnen verschillende aantallen protonen hebben. Dit betekent dat ze verschillende elementen kunnen zijn.
* Het aantal elektronen bepaalt de elektronische configuratie. Iso -elektronische soorten hebben dezelfde elektronische configuratie.
* iso -elektronische soorten hebben vaak vergelijkbare chemische eigenschappen. Dit komt door hun vergelijkbare elektronische configuraties.
Voorbeelden van iso -elektronische soorten:
* na⁺, ne, f⁻ (ze hebben allemaal 10 elektronen)
* mg²⁺, na⁺, ne (ze hebben allemaal 10 elektronen)
* ca²⁺, k⁺, ar (Allen hebben 18 elektronen)
Laat het me weten als je meer voorbeelden wilt of nog vragen hebt!
 Hoe worden de linkerkant van de Molicules van de chemische vergelijking genoemd?
Hoe worden de linkerkant van de Molicules van de chemische vergelijking genoemd?  Wat geeft het atoomnummer weer?
Wat geeft het atoomnummer weer?  Wat betekent oplossing in de wetenschap?
Wat betekent oplossing in de wetenschap?  Fluorescerend polymeer detecteert sporen van explosieven
Fluorescerend polymeer detecteert sporen van explosieven Biochemici melden een manier om de onsterfelijkheid van kankercellen met oligonucleotiden te stoppen
Biochemici melden een manier om de onsterfelijkheid van kankercellen met oligonucleotiden te stoppen
 Hoe draagt de vernietiging van bossen bij aan het broeikaseffect?
Hoe draagt de vernietiging van bossen bij aan het broeikaseffect?  Wetenschappers ontwikkelen een vrachtwagen om biomeststof te produceren
Wetenschappers ontwikkelen een vrachtwagen om biomeststof te produceren Griekenland mislukte reactie op olieramp:milieugroepen
Griekenland mislukte reactie op olieramp:milieugroepen Bij EPA, coronavirus verstoort onderzoek en roept vragen op over impact op luchtkwaliteit
Bij EPA, coronavirus verstoort onderzoek en roept vragen op over impact op luchtkwaliteit Zwakke wind in de Stille Oceaan zorgde voor recordbrekende zomerhittegolf in de zomer van 2019
Zwakke wind in de Stille Oceaan zorgde voor recordbrekende zomerhittegolf in de zomer van 2019
Hoofdlijnen
- Wanneer is DNA -onderzoek gecreëerd?
- Wat is de rol van nitrofying -bacteriën?
- De relatie tussen levende organismen in de aquatische omgeving?
- Schedels die wild zijn geworden:hoe en waarom sommige kikkers extreme hoofden ontwikkelden
- Hebben bacteriën een directe rol in de stikstofcyclus?
- Uit onderzoek blijkt hoe een suikergevoelig eiwit fungeert als een machine om de plantengroei (en de olieproductie) aan en uit te zetten
- Waar gaat de wetenschap zich voornamelijk over?
- Wat zijn DNA -vingerafdrukken?
- Kolonies tellen in de microbiologie
- Gericht op het verbeteren van verbindingstechnologieën voor lichtgewicht en zeer sterke constructies

- Neutronen schilderen atomair portret van prototypisch celsignaleringsenzym
- Ingenieurs maken transistors en elektronische apparaten volledig van draad
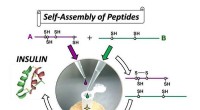
- Hoogrenderende synthese van insuline door op zelfassemblage gebaseerde organische chemie
- Video:Hoe communiceren planten met elkaar?

 Kunnen we voorspellen of een plantensoort exotisch zal worden?
Kunnen we voorspellen of een plantensoort exotisch zal worden?  Inlichtingenonderzoek ID's sleutelfactoren voor overheid, academische wereld, samenwerking in de industrie
Inlichtingenonderzoek ID's sleutelfactoren voor overheid, academische wereld, samenwerking in de industrie Welke celdeling die niet leidt tot genetische variatie?
Welke celdeling die niet leidt tot genetische variatie?  Talloze branden verspreidden zich van noord naar zuid in Oregon
Talloze branden verspreidden zich van noord naar zuid in Oregon Australië spant zich in om duizenden te bereiken die zijn gestrand door bosbranden
Australië spant zich in om duizenden te bereiken die zijn gestrand door bosbranden 125 inches is gelijk aan hoeveel voet en inches?
125 inches is gelijk aan hoeveel voet en inches?  Diamantpunten op nanometerschaal verbeteren de nanoproductie
Diamantpunten op nanometerschaal verbeteren de nanoproductie Welke planeet wordt de Greenhouse Planet genoemd?
Welke planeet wordt de Greenhouse Planet genoemd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

