
Wetenschap
Wat is de reactie tussen oxaalzuur en ammoniumhydroxide?
Hier is de evenwichtige chemische vergelijking:
H₂c₂o₄ (aq) + 2 nh₄oh (aq) → (nH₄) ₂c₂o₄ (aq) + 2 h₂o (l)
Verklaring:
* oxaalzuur is een diprotisch zuur, wat betekent dat het twee waterstofionen (H⁺) kan doneren.
* ammoniumhydroxide is een zwakke basis, die hydroxide -ionen biedt (OH⁻).
* Wanneer deze reageren, combineert de H⁺ van het zuur met de OH⁻ van de basis om water te vormen.
* De resterende ionen, ammonium (NH₄⁺) en oxalaat (C₂o₄²⁻), vormen het zout ammoniumoxalaat .
Observaties:
* De reactie is exotherme, wat betekent dat het warmte vrijgeeft.
* Als de concentratie van de reactanten hoog is, kan een wit neerslag van ammoniumoxalaat ontstaan.
Gebruik:
* Ammoniumoxalaat wordt gebruikt in analytische chemie als een neerslag voor calcium en andere metalen.
* Het wordt ook gebruikt als een mordant in het verven en als een reductiemiddel in fotografie.
 Is het waar of onwaar dat verdamping het omgekeerde is van condensatie?
Is het waar of onwaar dat verdamping het omgekeerde is van condensatie?  Tips voor het onthouden van sterke zuren en basen
Tips voor het onthouden van sterke zuren en basen  Legeronderzoekers doen explosieve ontdekking
Legeronderzoekers doen explosieve ontdekking PH niveau van regenwater
PH niveau van regenwater
Regenwater is van nature enigszins zuur, met een pH van ongeveer 5,0. Natuurlijke variaties en menselijke vervuilers kunnen ervoor zorgen dat de regen zuurder wordt. Afhankelijk van de regio, het seizoen en de aanwezigheid
 Wetenschappers onderzoeken de structuur van een sleutelgebied van telomerase-eiwit met een lange levensduur
Wetenschappers onderzoeken de structuur van een sleutelgebied van telomerase-eiwit met een lange levensduur
Hoofdlijnen
- Hoe een ‘evolutionaire speeltuin’ plantengenen bij elkaar brengt
- Een nieuwe studie geeft een belangrijk inzicht in de manier waarop moleculaire motoreiwitten betrokken zijn bij de overdracht van malaria
- van het volgende is een criterium voor het classificeren van organismen in koninkrijken?
- Wat zijn twee manieren waarop wetenschappers informatie verzamelen?
- Wat is een koolhydraat gevonden in een celwand van plantencellen?
- Wat is de onderliggende wetenschap voor alle wetenschappen?
- Kan de elektronenmicroscoop worden gebruikt om een levend monster te bestuderen en waarom?
- Seksrobots zijn er al, maar zijn ze gezond voor mensen?
- Wat maakt een leider? Aanwijzingen uit het dierenrijk
- Voorkomen van infectie, genezing vergemakkelijken:nieuwe biomaterialen van spinnenzijde

- De vorm van de dingen die komen gaan:flexibel, opvouwbare supercondensatoren voor energieopslag
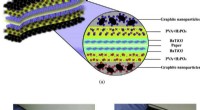
- Glycerolfosfaat dient als een terminator van glycaanverlenging bij kanker maligniteiten

- Geuren langer laten duren

- Wetenschappers voorspellen een nieuw superhard materiaal met unieke eigenschappen
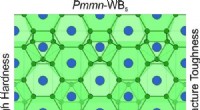
 Waar is Apollo opgevoed?
Waar is Apollo opgevoed?  Waarom is water gemengde alcohol lichter dan zoet water?
Waarom is water gemengde alcohol lichter dan zoet water?  Wat zijn enkele ongebruikelijke plaatsen waar u microben kunt vinden?
Wat zijn enkele ongebruikelijke plaatsen waar u microben kunt vinden?  3D-geprinte banden en schoenen die zichzelf repareren
3D-geprinte banden en schoenen die zichzelf repareren Hoe breng je de folower vergelijking Fe H20 - -Fe3O4 H2 in evenwicht?
Hoe breng je de folower vergelijking Fe H20 - -Fe3O4 H2 in evenwicht?  Welke kleur is de exosfeer?
Welke kleur is de exosfeer?  1e grote bosbrand in Zuid-Californië van 2020 blijft woeden
1e grote bosbrand in Zuid-Californië van 2020 blijft woeden Je hebt alle 6 stukjes van de puzzel nodig om stedelijke veerkracht op te bouwen, maar al te vaak is het de politiek die een gat laat?
Je hebt alle 6 stukjes van de puzzel nodig om stedelijke veerkracht op te bouwen, maar al te vaak is het de politiek die een gat laat?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

