
Wetenschap
Wanneer een kaliumatoom reageert met broom de wil?
* kalium (k) is een metaal in groep 1 van de periodiek systeem. Het heeft één valentie -elektron (elektron in de buitenste schaal).
* bromine (br) is een niet -metaal in groep 17 van het periodiek systeem. Het heeft zeven valentie -elektronen.
De reactie:
Kalium verliest gemakkelijk zijn enkele valentie -elektron om een stabiele edelgasconfiguratie te bereiken. Bromine krijgt één elektron om ook een stabiele adellijke gasconfiguratie te bereiken. Dit resulteert in een ionische binding:
* Kalium verliest een elektron en wordt een positief geladen ion (k+).
* Bromine krijgt een elektron en wordt een negatief geladen ion (Br-).
Deze tegengesteld geladen ionen trekken elkaar aan en vormen de ionische verbinding kaliumbromide (KBR).
De chemische vergelijking:
2k + br₂ → 2kbr
Deze vergelijking laat zien dat twee kaliumatomen reageren met één broommolecuul (BR₂) om twee formule -eenheden kaliumbromide te produceren.
 Wat is het pH -niveau van sherry -azijn?
Wat is het pH -niveau van sherry -azijn?  Tekenen van burn-out kunnen worden gedetecteerd in zweet
Tekenen van burn-out kunnen worden gedetecteerd in zweet Welke kleuren en golflengten van licht absorbeert phycoerythrin?
Welke kleuren en golflengten van licht absorbeert phycoerythrin?  Welke chemische test kan worden gebruikt om te bevestigen dat het in een reactie van een reactie koolstofdioxide is?
Welke chemische test kan worden gebruikt om te bevestigen dat het in een reactie van een reactie koolstofdioxide is?  Wat is de oxidatiereactie voor koolmonoxide en zuurstof?
Wat is de oxidatiereactie voor koolmonoxide en zuurstof?
 Media, non-profitorganisaties die klimaatverandering in kaart brengen, beïnvloedt hoe mensen over problemen denken, onderzoeken tonen aan
Media, non-profitorganisaties die klimaatverandering in kaart brengen, beïnvloedt hoe mensen over problemen denken, onderzoeken tonen aan Decennium aan gegevens toont aan dat FEMA-overstromingskaarten 3 van de 4 claims hebben gemist
Decennium aan gegevens toont aan dat FEMA-overstromingskaarten 3 van de 4 claims hebben gemist Poplar Tree Identification
Poplar Tree Identification Welke planeet in ons zonnestelsel staat bekend om zijn weelderige groene landschappen?
Welke planeet in ons zonnestelsel staat bekend om zijn weelderige groene landschappen?  Vee grazen met virtuele omheining toont potentieel om brandstofonderbrekingen voor natuurbranden te creëren, studie vondsten
Vee grazen met virtuele omheining toont potentieel om brandstofonderbrekingen voor natuurbranden te creëren, studie vondsten
Hoofdlijnen
- Waarom is diffusie belangrijk voor het leven van een cel?
- Welke 2 hormonen worden gemaakt in testes?
- Hoe worden angiospermen geclassificeerd?
- Hoe DNA-reparatie kanker helpt voorkomen
- Satellietkaarten bevorderen het behoud van de mangrove in China
- Celdeling in eukaryoten verschilt van celprokaryoten omdat?
- Wat is een zaadje in de biologie?
- Wat is de relatie tussen lichaamseiwitten en water?
- Een nieuw wapen tegen malaria:wetenschappers hebben een nieuw doelwit ontdekt om de verantwoordelijke parasiet te blokkeren
- Nieuw leven inblazen in kleurstofgevoelige zonnecellen

- Een veiligere manier om aziden te maken voor gebruik in klikchemie

- Op palladium gebaseerd metaalglas met hoge trombogene weerstand
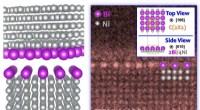
- Nieuw inzicht in het trainen van zeer reactieve chemische verbindingen

- besteld, door segregatie geïnduceerde bovenbouw aan algemene korrelgrenzen
 Een energiepiramide omhoog van onder naar boven de hoeveelheid neiging heeft?
Een energiepiramide omhoog van onder naar boven de hoeveelheid neiging heeft?  Een nieuwe miniatuuroplossing voor het opslaan van duurzame energie
Een nieuwe miniatuuroplossing voor het opslaan van duurzame energie Ondanks diepe staatsangsten toont onderzoek aan dat federale werknemers effectief en betrokken zijn, en niet subversief
Ondanks diepe staatsangsten toont onderzoek aan dat federale werknemers effectief en betrokken zijn, en niet subversief  Kan ik goud met zoutzuur reinigen?
Kan ik goud met zoutzuur reinigen?  Werken aan partnerbewuste humanoïde robotbesturing
Werken aan partnerbewuste humanoïde robotbesturing Wat zijn grondstoffen in sociale studies?
Wat zijn grondstoffen in sociale studies?  Wat zou er gebeuren met een systeem in evenwicht als de temperatuur zou veranderen?
Wat zou er gebeuren met een systeem in evenwicht als de temperatuur zou veranderen?  Wat zorgt ervoor dat circadiane klokken tikken?
Wat zorgt ervoor dat circadiane klokken tikken?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

