
Wetenschap
Wat is het verschil tussen een waterstofatoom en molecuul?
waterstofatoom
* Structuur: Een enkel proton (positief geladen) in de kern en een enkel elektron (negatief geladen) rond de kern.
* Symbool: H
* staat: Op zichzelf niet stabiel in de natuur; zeer reactief.
* eigenschappen: Extreem kleine, zeer reactieve, vormt zich gemakkelijk bindingen met andere atomen.
waterstofmolecuul
* Structuur: Twee waterstofatomen verbonden chemisch aan elkaar.
* Symbool: H₂
* staat: Stabiel en natuurlijk voorkomen in de atmosfeer.
* eigenschappen: Diatomic (twee atomen per molecuul), kleurloos, geurloos, smakeloos gas.
Belangrijkste verschillen:
* Aantal atomen: Een waterstofatoom is een enkel atoom, terwijl een waterstofmolecuul bestaat uit twee atomen.
* stabiliteit: Een waterstofatoom is zeer reactief en onstabiel, terwijl een waterstofmolecuul stabiel is en op natuurlijke wijze bestaat.
* chemische binding: Waterstofatomen zijn niet chemisch gebonden in een atoom, terwijl waterstofatomen in een molecuul aan elkaar worden gebonden.
Denk er zo aan:
* Een atoom is als een enkele Lego -baksteen. Het kan worden gebruikt om iets groters te bouwen, maar het is niet erg functioneel op zichzelf.
* Een molecuul is als een LEGO -structuur. Het is opgebouwd uit meerdere bakstenen (atomen) verbonden, waardoor het stabieler is en in staat is om specifieke functies uit te voeren.
 Welke reactie treedt op wanneer broom wordt toegevoegd aan een waterige oplossing van jodide -ionen?
Welke reactie treedt op wanneer broom wordt toegevoegd aan een waterige oplossing van jodide -ionen?  Onderzoekers leggen in realtime rondzwervende moleculaire fragmenten vast
Onderzoekers leggen in realtime rondzwervende moleculaire fragmenten vast Wat gebeurt er met de snelheidsconstante van een chemische reactie als de temperatuur stijgt?
Wat gebeurt er met de snelheidsconstante van een chemische reactie als de temperatuur stijgt?  Hoeveel mol kationen zitten er in 1,30 mol rmK 2 rmSO 4?
Hoeveel mol kationen zitten er in 1,30 mol rmK 2 rmSO 4?  Wat voor soort elementen worden gebruikt in een covalente binding?
Wat voor soort elementen worden gebruikt in een covalente binding?
 Canarische Eilanden houden stranden open ondanks algenbloei
Canarische Eilanden houden stranden open ondanks algenbloei Lava stroomt uit krater terwijl de Indonesische berg Merapi uitbarst
Lava stroomt uit krater terwijl de Indonesische berg Merapi uitbarst Wonder of luchtspiegeling? Atmosferische rivieren eindigen het droogtejaar in Californië met zware sneeuwval en regen
Wonder of luchtspiegeling? Atmosferische rivieren eindigen het droogtejaar in Californië met zware sneeuwval en regen  Lava overspoelt 100 huizen terwijl vulkaan Canarische Eilanden uitbarst
Lava overspoelt 100 huizen terwijl vulkaan Canarische Eilanden uitbarst Canada heeft eindelijk een klimaatplan waarmee het zijn koolstofdoelstellingen tegen 2030 kan halen
Canada heeft eindelijk een klimaatplan waarmee het zijn koolstofdoelstellingen tegen 2030 kan halen
Hoofdlijnen
- Onderzoek werpt licht op hoe antibiotica klittenband bacteriën doodt
- Waarom transporteurs echt belangrijk zijn voor celfabrieken
- Earth Microbiome Project:het microbioom van... alles in kaart brengen
- Menselijke Argonaute-eiwitten:wel of niet snijden?
- Coyotes zijn hier om te verblijven in Noord-Amerikaanse steden. Hoe je ze van een afstand kunt waarderen
- Wat is de dubbele helix?
- Wat was het resultaat van het voeren van zeekoeien met 100 ton sla? Ambtenaren denken na over lessen
- Hoe is variatie gunstig voor een populatie van organismen?
- Wat is de relatie tussen fotosynthese en koolhydraten?
- Vrijgave van medicijnen uit een supramoleculaire kooi

- Op weg naar het oplossen van oplosbaarheidsproblemen in de organische chemie
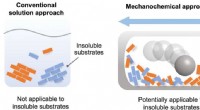
- Emissies van verhitte tabaksproducten onderzoeken

- Nieuwe kleurstoffen detecteren ziekte door hartslagsignalen

- Succesvolle toepassing van machine learning bij de ontdekking van nieuwe polymeren
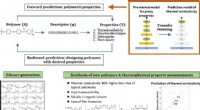
 Onderzoekers onderzoeken hoe inktvissen in het donker communiceren
Onderzoekers onderzoeken hoe inktvissen in het donker communiceren  Waarom werken hete luchtballonnen?
Waarom werken hete luchtballonnen?  Waarom is het menselijk ras zo dirkerend?
Waarom is het menselijk ras zo dirkerend?  Drijven stukjes ijs in zout water?
Drijven stukjes ijs in zout water?  Hoe cellen in plantenbladeren zichzelf organiseren om een optimaal gebied voor fotosynthese te garanderen
Hoe cellen in plantenbladeren zichzelf organiseren om een optimaal gebied voor fotosynthese te garanderen  Wat is het gebogen pad van een planeet rond de zon?
Wat is het gebogen pad van een planeet rond de zon?  Hoe het verwijderen van openbare monumenten werkt
Hoe het verwijderen van openbare monumenten werkt  Hoe is deze uitspraak allemaal op één en dezelfde manier van toepassing op grote meercellige organismen?
Hoe is deze uitspraak allemaal op één en dezelfde manier van toepassing op grote meercellige organismen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

