
Wetenschap
Als 400,0 ml 0,420 m NaCl wordt gemengd met 110,0 0.240 Wat is de uiteindelijke oplossing van de molariteit?
Hier leest u hoe u de molariteit van de uiteindelijke oplossing kunt berekenen:
1. Bereken de mol NaCl in elke oplossing:
* Oplossing 1: (0.400 L) * (0,420 mol/l) =0,168 mol NaCl
* Oplossing 2: (0.110 l) * (0,240 mol/l) =0,0264 mol NaCl
2. Bereken het totale mol NaCl:
* Totaal mol =0,168 mol + 0,0264 mol =0,1944 mol NaCl
3. Bereken het totale volume van de uiteindelijke oplossing:
* Totaal volume =0,400 l + 0,110 l =0,510 l
4. Bereken de uiteindelijke molariteit:
* Eindmolariteit =(totaal mol NaCl) / (totale volume van oplossing)
* Laatste molariteit =(0.1944 mol) / (0,510 l) = 0.381 m
Daarom is de molariteit van de uiteindelijke oplossing 0,381 m.
 Waarom is een ijzeratoom een ander element dan natriumatoom?
Waarom is een ijzeratoom een ander element dan natriumatoom?  Is een mengsel van kopersulfaatoplossingen?
Is een mengsel van kopersulfaatoplossingen?  Hoe wordt de reactiviteit van een element opnieuw geactiveerd aan de buitenste schaal?
Hoe wordt de reactiviteit van een element opnieuw geactiveerd aan de buitenste schaal?  Klein, snel, en zeer energiezuinig geheugenapparaat geïnspireerd op lithium-ionbatterijen
Klein, snel, en zeer energiezuinig geheugenapparaat geïnspireerd op lithium-ionbatterijen Verschillen tussen grafiet en koolstofvezel
Verschillen tussen grafiet en koolstofvezel
Hoofdlijnen
- Wat is Nadph in fotosynthese?
- Wat is er nodig om het einde van de cursus van de biologie te doorstaan?
- Hoe heet het membraan dat de ene cel van de andere scheidt?
- Waar vindt de transcriptie van ribonucleïnezuur RNA plaats in een cel?
- Geef de haaien niet de schuld:uit onderzoek blijkt waarom er steeds meer gehaakte tarpoenen worden gegeten
- Hoe u het hart van uw hond gezond kunt houden
- Ziet DNA er hetzelfde uit in elk organisme?
- Zien hoe evolutionaire mechanismen biologische diversiteit opleveren
- Welke twee paringsbacteriën AME cel-tot-celcontact door een dunne tijdelijke cytoplasmatische brug waardoor het plasmide van cel naar andere cel reist?
- Injecteerbare gel is veelbelovend als wondgenezend materiaal voor beroertes
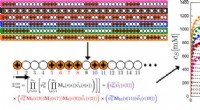
- Onderzoekers kunnen nu eigenschappen van ongeordende polymeren voorspellen
- Levende celmembranen kunnen hun componenten zelf sorteren door te ontmengen
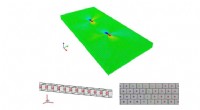
- Een nieuwe manier om stress te zien - met behulp van supercomputers
- Nieuwe sensor detecteert zeldzame metalen die in smartphones worden gebruikt
 Woonvoordeel? CEO's hebben de neiging bedrijven over te nemen op bekende terreinen
Woonvoordeel? CEO's hebben de neiging bedrijven over te nemen op bekende terreinen  Overdrijven hoeveel koolstofdioxide kan worden opgenomen door het planten van bomen, dreigt cruciale klimaatactie af te schrikken
Overdrijven hoeveel koolstofdioxide kan worden opgenomen door het planten van bomen, dreigt cruciale klimaatactie af te schrikken Eetbare, fluorescerende zijden tags kunnen nepmedicijnen opsporen
Eetbare, fluorescerende zijden tags kunnen nepmedicijnen opsporen Hoogtepunt:quasi-kristallijne bestelling op nanoschaal
Hoogtepunt:quasi-kristallijne bestelling op nanoschaal Hoe bewegen de deeltjes in een glas melk?
Hoe bewegen de deeltjes in een glas melk?  Zijn er wolken op de maan?
Zijn er wolken op de maan?  Waar op zoek naar Jupiter?
Waar op zoek naar Jupiter?  Het stevigere geslacht? Uit onderzoek blijkt dat vrouwelijke stamcellen beter werken
Het stevigere geslacht? Uit onderzoek blijkt dat vrouwelijke stamcellen beter werken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

