
Wetenschap
Welk volume waterstofchloride wordt geproduceerd door de reactie van 40 cm3 chloor met waterstof?
Stoichiometrie en volumeverhoudingen
* Chemische vergelijking: De reactie van chloor en waterstof is:
H₂ + Cl₂ → 2HCl
* molverhouding: De gebalanceerde vergelijking vertelt ons dat 1 mol chloor reageert met 1 mol waterstof om 2 mol waterstofchloride te produceren.
* Volume en mol: Het volume van een gas is recht evenredig met het aantal mol (bij constante temperatuur en druk). Dit is gebaseerd op de wet van Avogadro.
INFORMATIE GEBRUIKEN
Om het volume waterstofchloride te berekenen, moet u:
1. Volume waterstof: U moet het volume van waterstof weten dat reageert met het chloor.
2. Voorwaarden: U moet de temperatuur en druk weten waarop de reactie plaatsvindt. Hiermee kunt u mol omzetten in volume met behulp van de ideale gaswet.
Voorbeeld
Laten we zeggen dat de reactie bij standaardtemperatuur en druk (STP) is, waarbij 1 mol gas 22,4 L.
* Als u 40 cm³ chloor (dat is 0,04 L) met een gelijk volume waterstof (0,04 L) reageert, dan zou u produceren:
* 0,04 L Cl₂ x (2 mol HCl / 1 mol CL₂) =0,08 mol HCl
* 0,08 mol HCl X (22,4 l / 1 mol HCl) =1,79 l HCl
Conclusie
U hebt meer informatie nodig om dit probleem op te lossen. U hebt het volume waterstof en de omstandigheden (temperatuur en druk) nodig om het geproduceerde volume van waterstofchloride te berekenen.
 Voorbeelden van radio-isotoop en hun halfwaardetijd?
Voorbeelden van radio-isotoop en hun halfwaardetijd?  Verbrandt kooldioxide met een piepend geluid?
Verbrandt kooldioxide met een piepend geluid?  Wat ontstaat er als een zuur wordt geneutraliseerd door een hydroxide?
Wat ontstaat er als een zuur wordt geneutraliseerd door een hydroxide?  Raman-picoscopie scannen:een nieuwe methode voor het bepalen van de moleculaire chemische structuur
Raman-picoscopie scannen:een nieuwe methode voor het bepalen van de moleculaire chemische structuur Chemici creëren organische moleculen in een regenboog van kleuren die nuttig kunnen zijn als organische lichtgevende diodes
Chemici creëren organische moleculen in een regenboog van kleuren die nuttig kunnen zijn als organische lichtgevende diodes
 Door het coronavirus veroorzaakte reducties in de uitstoot van kooldioxide zijn nog niet waarneembaar in de atmosfeer
Door het coronavirus veroorzaakte reducties in de uitstoot van kooldioxide zijn nog niet waarneembaar in de atmosfeer Welke rots wordt gebruikt om een huidwasser te maken?
Welke rots wordt gebruikt om een huidwasser te maken?  Hoe categoriseer je een tornado als weergerelateerd geologisch van aard en/of veroorzaakt door mensen?
Hoe categoriseer je een tornado als weergerelateerd geologisch van aard en/of veroorzaakt door mensen?  Uit analyse blijkt dat Amerikaanse ecosystemen honderden kilometers naar het noorden verschuiven
Uit analyse blijkt dat Amerikaanse ecosystemen honderden kilometers naar het noorden verschuiven Zaadproductie en rekrutering van jonge bomen beïnvloeden de migratie als gevolg van de klimaatverandering
Zaadproductie en rekrutering van jonge bomen beïnvloeden de migratie als gevolg van de klimaatverandering
Hoofdlijnen
- Hoe heet de staart op een cel?
- Wat doet de verkeerde pH om een enzym vorm te geven?
- Nachtvliegers of dagjesmensen? Studie werpt licht op wanneer motten, vlinders zijn actief
- Welk spiercel -eiwit werkt als een ATPase -enzym?
- Wat is in een voedselketen of internet?
- Wat zijn de 10 Major Body Systems?
- Wat zijn de voordelen van prokaryoten?
- Waarom is het fossiele record belangrijk voor de evolutietheorie?
- Wat wordt beschreven door binaire splijting?
- Video:kleine vormveranderende polymeren ontwikkeld voor potentiële medische toepassingen

- Materiaalwetenschappers verdiepen zich in kwetsbaarheden die betrokken zijn bij tandbederf bij de mens
- Subtiliteit en de selectieve kunst van het scheiden van lanthaniden

- Uitgebreide elektronische structuurmethoden voor materiaalontwerp
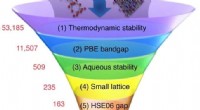
- Röntgenbeeldvorming geeft aanwijzingen voor breuk in solid-state batterijen

 Een nieuw ontdekte vorm van immuniteit helpt verklaren hoe bacteriën virussen bestrijden
Een nieuw ontdekte vorm van immuniteit helpt verklaren hoe bacteriën virussen bestrijden  De grootste halfgeleiderchipfabriek van Minnesota wordt nog groter
De grootste halfgeleiderchipfabriek van Minnesota wordt nog groter 115 cm gelijk hoeveel inches?
115 cm gelijk hoeveel inches?  Klimaat, ontwikkeling getipt voor Nobelprijs voor economie
Klimaat, ontwikkeling getipt voor Nobelprijs voor economie Math Games van het eerste, tweede en derde leerjaar
Math Games van het eerste, tweede en derde leerjaar Het medicijn van mieren:redding en behandeling van gewonde personen
Het medicijn van mieren:redding en behandeling van gewonde personen Nieuwe 3D-structuren worden met opmerkelijke precisie geassembleerd
Nieuwe 3D-structuren worden met opmerkelijke precisie geassembleerd Welke richting doet de luchtstromingen naar polen of weg van polen?
Welke richting doet de luchtstromingen naar polen of weg van polen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

