
Wetenschap
Wanneer natrium en chloride zich aansluiten bij een elektron van wordt overgebracht naar de vorm een binding die wordt genoemd?
Dit is waarom:
* natrium (na) Heeft één elektron in zijn buitenste schaal, waardoor het zeer reactief en enthousiast is om dat elektron te verliezen om een stabiele elektronenconfiguratie te bereiken.
* chloor (Cl) Heeft zeven elektronen in de buitenste schaal en heeft er nog een nodig om een stabiele configuratie te bereiken.
* overdracht: Natrium schenkt zijn enkele elektron aan chloor.
* ionen: Natrium, na een elektron te hebben verloren, wordt een positief geladen ion (Na+), terwijl chloor, dat een elektron heeft gewonnen, een negatief geladen ion wordt (Cl-).
* Elektrostatische aantrekkingskracht: De tegenovergestelde ladingen van de ionen trekken elkaar aan en vormen een ionische binding .
Deze elektrostatische aantrekkingskracht tussen het positief geladen natriumion en het negatief geladen chloride -ion is wat de twee atomen bij elkaar houden in een verbinding genaamd natriumchloride (NaCl) , of gemeenschappelijk tafelzout.
 Wat bestaat uit glycerol bevestigd aan drie vetzuren?
Wat bestaat uit glycerol bevestigd aan drie vetzuren?  Labtechnologie brengt Nobelprijswinnaar cryo-EM scherper in beeld
Labtechnologie brengt Nobelprijswinnaar cryo-EM scherper in beeld Chemische formule voor gehydrogeneerde palmpitolie?
Chemische formule voor gehydrogeneerde palmpitolie?  Wat is de kleur van pH -papier in oranje?
Wat is de kleur van pH -papier in oranje?  Akoestisch microfluïdisch platform scheidt circulerende tumorcellen voorzichtig en snel van bloedmonsters
Akoestisch microfluïdisch platform scheidt circulerende tumorcellen voorzichtig en snel van bloedmonsters
Hoofdlijnen
- Een antigeen stimuleert B -cellen om een specifiek te produceren Wat?
- Wetenschappers ontgrendelen de code om betere erwten te kweken
- Zal het hernoemen van karperkopieën helpen om ze onder controle te krijgen?
- Hoe menselijke transportgewoonten het gedrag van kleine mijten helpen verklaren
- Hoe groot zijn de meeste menselijke cellen?
- Wat zijn enkele veel voorkomende ziekten die worden veroorzaakt door anaerobe bacteriën?
- Hoe worden de pakketten informatie in elke cellen kern genoemd?
- Wat is de functie van ribosomen in cellen?
- Welk orgaan bestaat uit gemodificeerde postganglionische neuronen zonder dendrities of axonen?
- Nieuwe beeldvormingsmethode helpt bij waterzuivering

- Nieuw voorgestelde strategie biedt slimme flexibele neurale elektrode met hoge efficiëntie
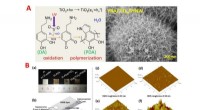
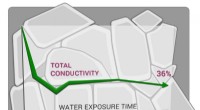
- Wetenschappers tonen aan dat een veelbelovende vaste elektrolyt hydrofoob is
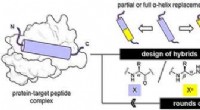
- Oligourea-foldamers bootsen peptiden alfa-helices na en binden effectief aan medicijndoelen
- Een energiezuiniger katalytisch proces om olefinen te produceren

 Wat is het hoogste gebouw ter wereld?
Wat is het hoogste gebouw ter wereld?  AC & DC-kenmerken
AC & DC-kenmerken  De ultieme verkleining:wonen in een zeecontainerhuis
De ultieme verkleining:wonen in een zeecontainerhuis  Hoe worden zonnepanelen in ons leven gebruikt?
Hoe worden zonnepanelen in ons leven gebruikt?  Wat is de diameter van 203 mm in inches?
Wat is de diameter van 203 mm in inches?  Hoeveel gram MgCl2 is nodig om van 700 ml een 1,4 M oplossing te maken?
Hoeveel gram MgCl2 is nodig om van 700 ml een 1,4 M oplossing te maken?  Instagram, PlayStation hit met storingen
Instagram, PlayStation hit met storingen NASA's close-up van orkaan Rosa toont een oogwenk
NASA's close-up van orkaan Rosa toont een oogwenk
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

