Wetenschap
Kan aceton waterstofbinding vormen met water?
Dit is waarom:
* aceton (CH3COCH3) heeft een carbonylgroep (C =O). Het zuurstofatoom in de carbonylgroep is enigszins elektronegatief, waardoor het gedeeltelijk negatief is (Δ-) en het koolstofatoom gedeeltelijk positief (Δ+).
* Water (H2O) heeft twee waterstofatomen gebonden aan een zuurstofatoom. Het zuurstofatoom is ook elektronegatief, waardoor het gedeeltelijk negatief is (δ-) en de waterstofatomen gedeeltelijk positief (Δ+).
waterstofbinding treedt op wanneer een gedeeltelijk positief waterstofatoom wordt aangetrokken tot een gedeeltelijk negatief atoom (meestal zuurstof, stikstof of fluor). Hoewel het zuurstofatoom in aceton waterstofbruggen van watermoleculen kan accepteren, zijn de waterstofatomen in aceton niet voldoende positief om sterke waterstofbruggen te vormen met het zuurstofatoom van water.
Daarom is de waterstofbinding tussen aceton en water zwakker dan de waterstofbinding tussen watermoleculen. Dit is de reden waarom aceton enigszins oplosbaar is in water, maar niet volledig mengbaar is.
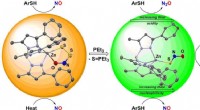
 Door elektronische verstoring bevorderd grensvlakpad voor gemakkelijke C-H-dissociatie
Door elektronische verstoring bevorderd grensvlakpad voor gemakkelijke C-H-dissociatie  Wat zijn chemische reactanten en de reactieproducten?
Wat zijn chemische reactanten en de reactieproducten?  Materiaal dat dingen koud houdt Warm & Warm
Materiaal dat dingen koud houdt Warm & Warm Hoe vindt u de fractionele overvloed van een isotoop
Hoe vindt u de fractionele overvloed van een isotoop Nieuwe inkjetprintmethode kan het ontdekken van medicijnen en geprinte gepersonaliseerde medicijnafgifte versnellen
Nieuwe inkjetprintmethode kan het ontdekken van medicijnen en geprinte gepersonaliseerde medicijnafgifte versnellen
Hoofdlijnen
- Kan prokaryotisch reageren op hun omgeving?
- Wat een specimencollectie helpt een wetenschapper onderzoek te doen?
- Hoe draagt Gene Shuffling bij aan Variety Int the Pool?
- Waarom zijn amfibieën verstoken van schalen?
- Biologen ontdekken hoe 'stille' mutaties de eiwitproductie beïnvloeden
- Uit onderzoek blijkt hoe vrouwelijke immuuncellen hun tweede X-chromosoom uitgeschakeld houden
- Hebben mannen en vrouwen verschillende hersenen?
- Wat is een manier om bacteriën te helpen het milieu?
- Sterven mensen in politiehechtenis aan opgewonden delirium?
 Welke kracht van de zon trekt op aarde en houdt het in een baan om?
Welke kracht van de zon trekt op aarde en houdt het in een baan om?  Help NASA-asteroïdemissie bij het kiezen van een voorbeeldlocatie met behulp van PSI's CosmoQuest
Help NASA-asteroïdemissie bij het kiezen van een voorbeeldlocatie met behulp van PSI's CosmoQuest Wat is wolk van stof en gas waar de ster geboren?
Wat is wolk van stof en gas waar de ster geboren?  Afbeelding:Gedeeltelijke zonsverduistering vanuit de ruimte
Afbeelding:Gedeeltelijke zonsverduistering vanuit de ruimte Zegt u een isolator van warmte of slechte geleider die correct is of beide correct zijn?
Zegt u een isolator van warmte of slechte geleider die correct is of beide correct zijn?  Wat is het blokkeren van zonlicht voor de maan die optreedt wanneer de aarde rechtstreeks tussen zon en maan is?
Wat is het blokkeren van zonlicht voor de maan die optreedt wanneer de aarde rechtstreeks tussen zon en maan is?  Is een prachtige zangvogel een invasieve soort geworden in Groot-Brittannië?
Is een prachtige zangvogel een invasieve soort geworden in Groot-Brittannië?  Wat is het in vredesnaam? Consumenten kunnen worden voorbereid om hybride producten te begrijpen
Wat is het in vredesnaam? Consumenten kunnen worden voorbereid om hybride producten te begrijpen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com