
Wetenschap
Welk gas heeft een dichtheid van 2,104 GL bij 303 K en 133 kPa uit deze hij ne ar kr xe?
1. Begrijp de relatie tussen dichtheid, druk en temperatuur
De ideale gaswet helpt ons de relatie te begrijpen:
* pv =nrt
Waar:
* p =Druk (in PA)
* v =volume (in m³)
* n =Aantal mol
* r =ideale gasconstante (8.314 J/mol · k)
* t =temperatuur (in k)
We kunnen deze vergelijking herschikken om op te lossen voor dichtheid (ρ):
* ρ =(n * m) / v
* ρ =(p * m) / (r * t)
Waar:
* M =Molaire massa van het gas (in g/mol)
2. Converteren eenheden
* druk (p): 133 kPa =133.000 pa
* temperatuur (t): 303 K (al in Kelvin)
3. Bereken de molaire massa van elk gas
* hij: 4,00 g/mol
* ne: 20.18 g/mol
* ar: 39,95 g/mol
* kr: 83,80 g/mol
* xe: 131.29 g/mol
4. Gebruik de dichtheidsvergelijking om het bijpassende gas te vinden
Sluit de bekende waarden aan (druk, temperatuur, r) en de molaire massa (m) van elk gas in de dichtheidsvergelijking. Bereken de dichtheid voor elk gas en kijk welke overeenkomt met de gegeven dichtheid (2.104 g/L).
Voorbeeldberekening (voor argon):
* ρ =(p * m) / (r * t)
* ρ =(133.000 PA * 39,95 g/mol)/(8.314 J/mol · k * 303 k)
* ρ ≈ 2.104 g/l
Resultaat:
Het gas met een dichtheid van 2,104 g/l bij 303 K en 133 kPa is argon (AR) .
 Is zilver een molecuul of een atoom?
Is zilver een molecuul of een atoom?  Welke kernreactie combineert gas om helium te vormen en produceert het grootste deel van de energie van de zon?
Welke kernreactie combineert gas om helium te vormen en produceert het grootste deel van de energie van de zon?  Oppervlaktechemie onthult bijtende geheimen
Oppervlaktechemie onthult bijtende geheimen Nieuwe benadering van medische beeldvorming ontsluit potentieel voor verbeterde diagnoses en interventies
Nieuwe benadering van medische beeldvorming ontsluit potentieel voor verbeterde diagnoses en interventies Hoeveel niet -bindingsparen zijn er in CL4?
Hoeveel niet -bindingsparen zijn er in CL4?
 Wat zijn de wetenschappelijke methode beperkt tot het onderzoeken van fenomenen die (selecteren alle toepassen)?
Wat zijn de wetenschappelijke methode beperkt tot het onderzoeken van fenomenen die (selecteren alle toepassen)?  Dieseltreinen kunnen passagiers blootstellen aan uitlaatgassen
Dieseltreinen kunnen passagiers blootstellen aan uitlaatgassen Wetenschappers pleiten voor langdurig onderzoek naar de verdeling van ozonbronnen
Wetenschappers pleiten voor langdurig onderzoek naar de verdeling van ozonbronnen Waarom zijn tropische bossen zo divers? Nieuwe studie onderzoekt de rol van 'natuurlijke vijanden'
Waarom zijn tropische bossen zo divers? Nieuwe studie onderzoekt de rol van 'natuurlijke vijanden'  De voorwaarden scheppen voor een wereldwijd rechtvaardige energietransitie
De voorwaarden scheppen voor een wereldwijd rechtvaardige energietransitie
Hoofdlijnen
- Welk organisme is de meest gespecialiseerde amoeba bacteriën grizzlybeer kever?
- Waarom 'democratie door afschrikking' in de Verenigde Staten zou kunnen verzwakken
- Studie vindt hoe de overlevingstijd van stamcellen kan worden verlengd
- Wat is de kern van de dierencellen?
- Mycoheterotrofe planten als sleutel tot het Wood Wide Web
- Onderzoekers brengen de anatomie van het houten borstsyndroom bij vleeskuikens in kaart
- Welk gevoel kan gemakkelijk worden gebruikt om de aanwezigheid van gist op kweekplaat te bepalen?
- Welke eiwitten in het celmembraan helpen bij het importeren van biochemische reacties in cel?
- Wat zijn grafologische kenmerken?
- Kalkoenborst met een lager natriumgehalte wint sensorische test dan volzoutoptie

- De route voor de productie van ethyleen
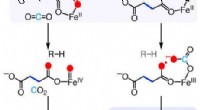
- Nieuwe katalysator zet broeikasgassen om in waterstofgas
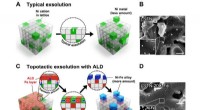
- AI-aangedreven microscoop kan binnen enkele minuten kankermarges controleren

- Hoe verandert deze blauwe bloementhee van kleur?

 Hoe de maanstanden te vinden
Hoe de maanstanden te vinden  Wat is de dichtheid van benzine en water?
Wat is de dichtheid van benzine en water?  Wat is het effect van HCl op pH als water?
Wat is het effect van HCl op pH als water?  Welke energie kan in veel verschillende vormen worden omgezet?
Welke energie kan in veel verschillende vormen worden omgezet?  Wat wordt vergeleken met Saturnus en Neptunus, Mercury Mars hebben groter:(1) perioden van revolutie (2) orbitale snelheden (3) afstanden van de zon (4) equatoriale diameters?
Wat wordt vergeleken met Saturnus en Neptunus, Mercury Mars hebben groter:(1) perioden van revolutie (2) orbitale snelheden (3) afstanden van de zon (4) equatoriale diameters?  Montreal breekt temperatuurrecord in mei terwijl de hittegolf Canada in zijn greep houdt
Montreal breekt temperatuurrecord in mei terwijl de hittegolf Canada in zijn greep houdt Het noorderlicht kan vanavond het vasteland van de VS verblinden
Het noorderlicht kan vanavond het vasteland van de VS verblinden  Is kernenergie veilig?
Is kernenergie veilig?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

