Wetenschap
Wat is een belangrijke reden dat een toename van de temperatuur de snelheid van de chemische reactie verhoogt?
Hier is hoe het werkt:
* Verhoogde kinetische energie: Wanneer u een systeem verwarmt, verhoogt u de gemiddelde kinetische energie van de moleculen. Dit betekent dat ze sneller bewegen en vaker tegen elkaar botsen.
* Meer effectieve botsingen: Om een chemische reactie te laten optreden, moeten moleculen botsen met voldoende energie en in de juiste oriëntatie. Hogere kinetische energie betekent:
* Meer botsingen: De moleculen bewegen sneller en vergroten de kans dat ze tegen elkaar botsen.
* Meer energieke botsingen: De botsingen zijn krachtiger, waardoor het waarschijnlijker is dat ze de activeringssenergiebarrière zullen overwinnen die nodig is om de reactie te laten plaatsvinden.
Activeringsenergie: Dit is de minimale hoeveelheid energie die nodig is om een reactie te starten. De verhoogde kinetische energie van hogere temperaturen geeft meer moleculen de noodzakelijke energie om deze barrière te overwinnen.
Denk er zo aan: Stel je voor dat je probeert een zware rots bergop te duwen. Hoe hoger je energieniveau (zoals wanneer je rent), hoe groter de kans dat je de rots met succes over de heuvel moet duwen. In deze analogie vertegenwoordigt de rots de activeringsenergiebarrière en je energieniveau vertegenwoordigt de kinetische energie van de moleculen.
Opmerking: Hoewel temperatuur een belangrijke factor is, kunnen andere variabelen zoals de concentratie van reactanten en de aanwezigheid van katalysatoren ook de snelheid van een chemische reactie aanzienlijk beïnvloeden.
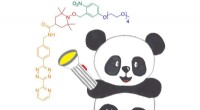
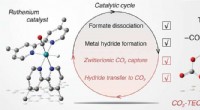
 Bevordering van elektroreductie van stikstofmonoxide tot ammoniak via elektronenrijk Cu gemoduleerd door Ru-doping
Bevordering van elektroreductie van stikstofmonoxide tot ammoniak via elektronenrijk Cu gemoduleerd door Ru-doping Hoe een kernreactor werkt
Hoe een kernreactor werkt  Wat is de atomaire structuur van het menselijke atoom?
Wat is de atomaire structuur van het menselijke atoom?  Welke informatie luister in een elementen vierkant op het periodiek systeem?
Welke informatie luister in een elementen vierkant op het periodiek systeem?  Welke organische basis is te vinden in ATP?
Welke organische basis is te vinden in ATP?
 Gaan vissen? Dat hebben we al 42.000 jaar
Gaan vissen? Dat hebben we al 42.000 jaar  Belang van ademhaling
Belang van ademhaling Waarom kiezen muggen voor ons? Lindy McBride is met de zaak bezig
Waarom kiezen muggen voor ons? Lindy McBride is met de zaak bezig  Olieramp in Orange County laat veel aanwijzingen achter, doodlopende wegen en mysteries, maar weinig antwoorden
Olieramp in Orange County laat veel aanwijzingen achter, doodlopende wegen en mysteries, maar weinig antwoorden Is de kiel-snavel toucan een omnivore carnivoor of een herbivoor?
Is de kiel-snavel toucan een omnivore carnivoor of een herbivoor?
Hoofdlijnen
- Welke rol speelt RNA bij de eiwitproductie?
- Een schimmel die brood opstrijdt, wordt gebeld?
- Rol van sucrose in DNA -isolatie uit menselijk bloed?
- Bloed is gemaakt van ongeveer één halve cellen en celonderdelen vloeistof genaamd wat?
- Wat zijn de functies van het septum in een regenworm?
- Wat is het nut van chloroform in DNA -extractie uit organismen?
- 'Vliegende vaccinator':kunnen genetisch gemanipuleerde muggen een nieuwe strategie tegen malaria bieden?
- Voorbeelden van diffusie in organen
- Wat kan jouw spuug je vertellen over DNA?
 Rotatievorm van spontane kristallografische ordening ontdekt in ferro-materiaal
Rotatievorm van spontane kristallografische ordening ontdekt in ferro-materiaal Vervuiling voorspellen met internet of things
Vervuiling voorspellen met internet of things Wat is de vorm van een vallei achtergelaten door Glacier?
Wat is de vorm van een vallei achtergelaten door Glacier?  Hoeveel chromosomen heeft een somatische cel in de mens?
Hoeveel chromosomen heeft een somatische cel in de mens?  Zitten dieren vast in de tijd?
Zitten dieren vast in de tijd?  Iets dat dezelfde functie uitvoert als ribosoom?
Iets dat dezelfde functie uitvoert als ribosoom?  EU-antitrustboetes:Google leidt Google naar toppositie
EU-antitrustboetes:Google leidt Google naar toppositie Economen waarschuwen dat oplossingen voor palmolie onbedoelde gevolgen kunnen hebben
Economen waarschuwen dat oplossingen voor palmolie onbedoelde gevolgen kunnen hebben
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com