
Wetenschap
Is er een ionische verbinding zich waarschijnlijk tussen fluor en koolstof?
* Elektronegativiteitsverschil: Fluor is het meest elektronegatieve element, terwijl koolstof een relatief matige elektronegativiteit heeft. Het verschil in elektronegativiteit tussen hen is significant, maar niet groot genoeg om een volledige overdracht van elektronen te creëren, wat het bepalende kenmerk is van een ionische binding.
* Koolstofbinding neigingen: Carbon geeft er de voorkeur aan om covalente bindingen te vormen door elektronen te delen. Het vormt gemakkelijk vier covalente bindingen, waardoor het een stabiele octetconfiguratie kan bereiken.
* fluor's bindingen: Fluor, hoewel zeer elektronegatief, vormt ook gemakkelijk covalente bindingen. Het vormt meestal één covalente binding om een stabiel octet te bereiken.
Hoewel er misschien een mate van ionisch karakter is in een koolstof-fluorinebinding (vanwege het elektronegativiteitsverschil), is de binding voornamelijk covalent. Daarom worden de verbindingen gevormd tussen koolstof en fluor covalente verbindingen genoemd , zoals tetrluoromethaan (cf₄).
 Hoe verhoogt het gebruik van synthetische producten zoals plastic de fossiele brandstoffen?
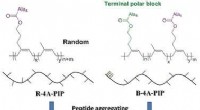
Hoe verhoogt het gebruik van synthetische producten zoals plastic de fossiele brandstoffen?  Peptiden die als pil kunnen worden ingenomen
Peptiden die als pil kunnen worden ingenomen Hoeveel protonen en elektronen heeft zuurstof in een atoom?
Hoeveel protonen en elektronen heeft zuurstof in een atoom?  De meest stabiele boornitridestructuur voorspellen met kwantumsimulaties
De meest stabiele boornitridestructuur voorspellen met kwantumsimulaties Kids Density-experimenten met zout, water en eieren
Kids Density-experimenten met zout, water en eieren
Hoofdlijnen
- Kunnen eiwitten afzonderlijke domeinen hebben met verschillende structuren en functies?
- Een grotere rijkdom aan plantensoorten is misschien niet voldoende om ecosystemen te beschermen tegen de ergste gevolgen van klimaatextremen
- Waarom het idee dat het Engels een gemeenschappelijke Angelsaksische oorsprong heeft, een mythe is
- Wat maakt goede wetenschappelijke kennis?
- Wat is de reproductieve functie van een stijl?
- Habitat: definitie, soorten en voorbeelden
- Hebben octopussen, inktvissen en krabben emoties?
- Waarom demonstreren alle cellen de aanwezigheid van intracellulaire structuren?
- Hoe dierproeven werken
- Studie ontdekt nieuw toedieningssysteem dat bacteriële infecties kan helpen voorkomen
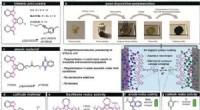
- Chemici gebruiken elektrochemie om de productie van medicijnen te versterken

- Een volledig organische protonenbatterij die wordt geactiveerd voor duurzame energieopslag
- Polymeer afgeleid van materiaal in de schelpen van garnalen kan geneesmiddelen tegen kanker afleveren op tumorplaatsen
- Biomimetische strategie leidt tot sterke, recyclebaar rubber
 Kaliumnitraatreactie-experimenten
Kaliumnitraatreactie-experimenten  Wat voor soort verschuiving in het spectrum zou je verwachten van een ster die dezelfde richting als de aarde bewoog bij Speed Earth?
Wat voor soort verschuiving in het spectrum zou je verwachten van een ster die dezelfde richting als de aarde bewoog bij Speed Earth?  Hoe vergroot je de amplitude van een trommel?
Hoe vergroot je de amplitude van een trommel?  Italië vertelt Ryanair, Wizz Air stopt met opladen van bagage
Italië vertelt Ryanair, Wizz Air stopt met opladen van bagage Hoeveel lumen in een halogeenlamp van 18 watt?
Hoeveel lumen in een halogeenlamp van 18 watt?  Als een ster een parallax van 0,05 heeft, is de afstand in lichtjaren ongeveer?
Als een ster een parallax van 0,05 heeft, is de afstand in lichtjaren ongeveer?  Sugeert de term cultureel landschap een zichtbare afdruk van menselijke activiteit op de natuurlijke omgeving?
Sugeert de term cultureel landschap een zichtbare afdruk van menselijke activiteit op de natuurlijke omgeving?  Wat is het verschil in tijd tussen het zonnejaar en het maanjaar?
Wat is het verschil in tijd tussen het zonnejaar en het maanjaar?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

