
Wetenschap
Hoe verschillen een zwavelmolecuul en dioxide?
zwavel (s):
* element: Zwavel is een niet-metaal element dat op natuurlijke wijze in zijn elementaire vorm wordt aangetroffen.
* uiterlijk: Het is een gele, brosse vaste stof.
* Structuur: Zwavelatomen kunnen verschillende structuren vormen, waaronder ringen en ketens. In zijn meest voorkomende vorm is het een ring van 8 zwavelatomen (S₈).
* Reactiviteit: Relatief niet -reactief in zijn elementaire vorm, maar het kan reageren met andere elementen om verbindingen te vormen.
zwaveldioxide (So₂):
* verbinding: Zwaveldioxide is een verbinding gevormd door de combinatie van zwavel en zuurstof.
* uiterlijk: Het is een kleurloos gas met een scherpe geur.
* Structuur: Het heeft een gebogen moleculaire structuur, met een zwavelatoom dubbel gebonden aan twee zuurstofatomen.
* Reactiviteit: Reactiever dan elementaire zwavel. Het lost in water op om zwavelzuur (h₂so₃) te vormen, waardoor het zuur is. Het is een grote luchtverontreiniging.
Belangrijkste verschillen:
* Samenstelling: Zwavel is een puur element, terwijl zwaveldioxide een verbinding is.
* Structuur: Zwavel kan in verschillende structuren bestaan, terwijl zwaveldioxide een specifieke gebogen structuur heeft.
* Reactiviteit: Elementaire zwavel is minder reactief dan zwaveldioxide.
Samenvattend: Zwavel en zwaveldioxide zijn verschillende stoffen met verschillende chemische samenstellingen, structuren en reactiviteit.
 Video:De boerderij van de toekomst?
Video:De boerderij van de toekomst? Hoe beïnvloedt waterverontreiniging vis?
Hoe beïnvloedt waterverontreiniging vis?  Nieuwe meettechniek vindt schadelijke PFAS in binnenlucht
Nieuwe meettechniek vindt schadelijke PFAS in binnenlucht Onderzoek suggereert dat mensen nu meer chemisch afval produceren dan getest kan worden
Onderzoek suggereert dat mensen nu meer chemisch afval produceren dan getest kan worden De wereldhonger naar olie blijft groeien, met SUV's een belangrijke boosdoener
De wereldhonger naar olie blijft groeien, met SUV's een belangrijke boosdoener
Hoofdlijnen
- Welk koninkrijk is uitsluitend heterotrofe, waaronder veel roofdieren en parasieten?
- Rapport:Er zijn geen goede of slechte oliegewassen, alleen goede en slechte praktijken
- Welke organel als leeg zou de plant ertoe leiden dat?
- Hoe het menselijk geheugen werkt
- Mysterieus bodemvirusgen voor het eerst gezien
- Wat maakt twee soorten verschillend?
- Waarom reageren planten- en diercellen anders op dezelfde manier als dezelfde oplossingen?
- Welk scholing is nodig om een menselijke bioloog te worden?
- Wat is de allelen van Gene die een organisme bevat?
- Ontmengen met lasers om nieuwe kristallen te maken
- Hernieuwbare energiebronnen kunnen de uitlaatemissies drastisch verminderen

- Onderzoekers karakteriseren moleculaire scharen voor plastic afval
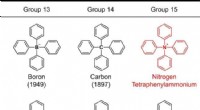
- Synthese van tetrafenylammonium:bevestiging van het bestaan van het fantoomion
- Een materiaal met een bijzondere twist:2-D molybdeendiselenidekristal

 Elektron-gat-recombinatiemechanisme in halide-perovskieten
Elektron-gat-recombinatiemechanisme in halide-perovskieten Hoe mensen AI leren om beter te worden in tweede gissen
Hoe mensen AI leren om beter te worden in tweede gissen Wat bevindt zich op 0 graden en waar de Equator Prime Meridian Cross?
Wat bevindt zich op 0 graden en waar de Equator Prime Meridian Cross?  Nieuwe studie opent de deur naar solid-state apparaten die aangeslagen elektronen gebruiken
Nieuwe studie opent de deur naar solid-state apparaten die aangeslagen elektronen gebruiken Komeet 67P/Churyumov-Gerasimenko is veel jonger dan eerder werd gedacht
Komeet 67P/Churyumov-Gerasimenko is veel jonger dan eerder werd gedacht Zout meer, vijvers borrelen mogelijk onder de zuidpool van Mars
Zout meer, vijvers borrelen mogelijk onder de zuidpool van Mars Wat is de afstand tot de zon?
Wat is de afstand tot de zon?  Wat reist in de ruimte?
Wat reist in de ruimte?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

