
Wetenschap
Energiekloof tussen de opgewonden en gemalen toestanden voor natriumion?
* Natriumionen hebben geen elektronische overgangen zoals atomen: Natriumionen hebben hun valentie -elektron verloren, wat betekent dat ze alleen gevulde elektronenschalen hebben. Dit betekent dat er geen direct beschikbare energieniveaus zijn voor elektronenovergangen zoals in neutrale atomen.
* energieniveaus worden beïnvloed door de omgeving: Zelfs als we het natriumatoom (NA) beschouwen, zou de energiekloof tussen zijn grond en geëxciteerde toestanden afhangen van zijn omgeving. Factoren zoals:
* Druk: Hogere druk kan de energieniveaus verlagen.
* Temperatuur: Temperatuur beïnvloedt de kans dat elektronen geëxciteerde toestanden bezetten.
* Aanwezigheid van andere ionen of moleculen: Interacties met andere soorten kunnen de energieniveaus veranderen.
In plaats van een specifieke energiekloof kunnen we praten over de ionisatie -energie van natrium. De ionisatie -energie is de minimale energie die nodig is om een elektron uit de buitenste schaal van een gasvormige atoom in zijn grondtoestand te verwijderen.
* Voor natrium is de ionisatie -energie ongeveer 495,8 kJ/mol. Dit vertegenwoordigt de energie die nodig is om het enkele valentie -elektron van een natriumatoom af te strippen om een natriumion te vormen.
Samenvattend: Het concept van energiekloof is niet direct toepasbaar op natriumionen. De ionisatie -energie van natrium biedt een maat voor de energie die nodig is om een natriumion te creëren uit een neutraal atoom.
 De levenscyclus van Selaginella
De levenscyclus van Selaginella Het begrijpen van het thermale landschap van een rivier kan de sleutel zijn om het te redden
Het begrijpen van het thermale landschap van een rivier kan de sleutel zijn om het te redden Welke klimaten worden gevonden in de VS en niet in Canada?
Welke klimaten worden gevonden in de VS en niet in Canada?  Komt natuurlijk? Wandelende wandelende takken gebruiken om natuurlijke selectie en de voorspelbaarheid van evolutie te bestuderen
Komt natuurlijk? Wandelende wandelende takken gebruiken om natuurlijke selectie en de voorspelbaarheid van evolutie te bestuderen  Stijgende temperaturen en menselijke activiteit zorgen voor meer stormvloed en plotselinge overstromingen
Stijgende temperaturen en menselijke activiteit zorgen voor meer stormvloed en plotselinge overstromingen
Hoofdlijnen
- Hoe receptoren voor medicijnen in cellen werken
- Darmmicrobioom helpt beren met zeer verschillende diëten om dezelfde grootte te bereiken
- Wat is een voorbeeld van symbiose in het graslandbioom?
- Waarom wordt pseudowetenschap niet beschouwd als echte wetenschap?
- Hoe analyseren wetenschappers gegevens die ze verzamelen?
- De volgorde die leidt naar de eerste eukaryotische cel?
- De verpakking van DNA in chromosomen
- Het ontrafelen van de redenen waarom massale uitstervingen plaatsvinden
- Welk proces vindt niet plaats in dierlijke cellen?
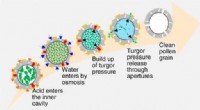
- Pollenschillen schoonmaken
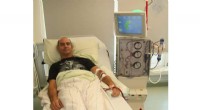
- Betaalbare en mobiele zuivering van dialysewater
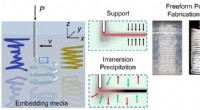
- Unieke methode om vrije-vormstructuren van thermoplasten te fabriceren in microdeeltjesgels
- Gesmolten staal monitoren met laser – uitvinding van staalexperts kan de industrie miljoenen besparen

- Toppen van waterige golven kunnen essentiële chemicaliën transporteren in een industrieel scheidingsproces
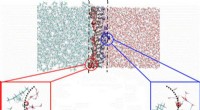
 Doorbraak in de zoektocht naar op grafeen gebaseerde elektronica
Doorbraak in de zoektocht naar op grafeen gebaseerde elektronica Welke twee grote nieuwigheden maakten de eerste kolonisatie van terrestrische habitats door planten mogelijk?
Welke twee grote nieuwigheden maakten de eerste kolonisatie van terrestrische habitats door planten mogelijk?  Wat zijn de vijf tropische niveaus voor een ecologische piramide?
Wat zijn de vijf tropische niveaus voor een ecologische piramide?  Hoe te vinden Area
Hoe te vinden Area Onderzoekers vinden overgangspunt in halfgeleider nanomaterialen
Onderzoekers vinden overgangspunt in halfgeleider nanomaterialen Wat bevat de kern van een atoom niet?
Wat bevat de kern van een atoom niet?  Minder auto's een verstandig plan voor een leefbare toekomst
Minder auto's een verstandig plan voor een leefbare toekomst Hoe mensen Spaans spreken, bepaalt het oordeel, vindt nieuwe studie
Hoe mensen Spaans spreken, bepaalt het oordeel, vindt nieuwe studie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

