
Wetenschap
Wat zijn de fasen van zout?
* solide: Dit is de meest voorkomende fase van zout die we tegenkomen. Het is een kristallijne structuur waar natrium (NA) en chloride (CL) ionen strak worden verpakt. Dit is wat we meestal beschouwen als tafelzout.
* vloeistof: Zout kan smelten bij hoge temperaturen (ongeveer 801 ° C of 1474 ° F). In deze vloeibare fase zijn de ionen nog steeds aanwezig, maar ze zijn niet langer vergrendeld in een rigide structuur en kunnen vrijer bewegen.
* gas: Bij nog hogere temperaturen kan zout verdampen en een gas worden. In deze fase zijn de ionen volledig van elkaar gescheiden en bestaan ze als individuele atomen of moleculen.
Er is ook een vierde fase van materie genaamd plasma , maar het wordt meestal niet aangetroffen met zout in dagelijkse situaties. Plasma is een oververhitte toestand waar elektronen van atomen worden gestript, waardoor een mengsel van vrije ionen en elektronen ontstaat.
Het is belangrijk op te merken dat hoewel de fase-overgangen voor zout goed zijn gedefinieerd, zout ook kan bestaan in verschillende vormen binnen de vaste fase. Tafelzout is bijvoorbeeld een fijnkorrelige vorm van natriumchloride, terwijl rotszout een grotere, meer grofkorrelige vorm is.
 Waarom J -waarde voor wederzijds gekoppelde waterstofatomen berekend uit de NMR -print komt vaak niet overeen?
Waarom J -waarde voor wederzijds gekoppelde waterstofatomen berekend uit de NMR -print komt vaak niet overeen?  Als water kookt, verandert het dan in waterstofmoleculen en zuurstofmoleculen?
Als water kookt, verandert het dan in waterstofmoleculen en zuurstofmoleculen?  3D-printen van zetmeel voor gepersonaliseerde medicijnontwikkeling
3D-printen van zetmeel voor gepersonaliseerde medicijnontwikkeling Wat is de woordvergelijking voor calcium met fluor?
Wat is de woordvergelijking voor calcium met fluor?  Reageert sterk zuur met base?
Reageert sterk zuur met base?
Hoofdlijnen
- Wat zijn de 3 fasen in de vorming van een nieuwe soort?
- Burgerwetenschappers ontdekken zes nieuwe soorten kevers in Borneo
- Onderzoek laat zien hoe cellen grote genen verwerken
- Moleculaire biologie:zijn snel prolifererende cellen epigenetisch kneedbaar?
- Welke dieren hebben witte sclera?
- Hoe een infectieuze tumor bij Tasmaanse duivels zich ontwikkelde terwijl deze zich verspreidde
- Welk orgaan in planten dat aseksuele reproductie uitvoert?
- Kanker-kameleons: hoe sommige agressieve kankercellen chemotherapie “hacken”
- Wat doen witte bloedcellen naar bacteriën?
- Apparaat haalt water uit droge lucht, alleen aangedreven door de zon

- Lasertechniek kan de deur openen naar efficiëntere schone brandstoffen
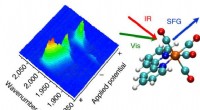
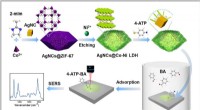
- Nieuwe SERS-sensor helpt bij het detecteren van aldehydegassen
- Innovatiepioniers scoren wereldprimeur voor duurzaam bouwen met grafeenbeton

- Kleine sensoren ontwikkeld om de geheimen van hersenchemie te bestuderen

 Steile kliffen zijn uitgehouwen door wat?
Steile kliffen zijn uitgehouwen door wat?  Heeft Venus langere maanden dan de aarde?
Heeft Venus langere maanden dan de aarde?  Drake breekt nieuw streamingrecord - in videogames
Drake breekt nieuw streamingrecord - in videogames Een essentiële leemte in klimaatmodellen opvullen
Een essentiële leemte in klimaatmodellen opvullen Van overstromingen in Brazilië en Houston tot brute hitte in Azië:extreem weer lijkt bijna overal
Van overstromingen in Brazilië en Houston tot brute hitte in Azië:extreem weer lijkt bijna overal  Tijd om te profiteren van COVID-19-verstoringen om groener gedrag vast te leggen
Tijd om te profiteren van COVID-19-verstoringen om groener gedrag vast te leggen Hoe de vierkante meters van een kamer te berekenen
Hoe de vierkante meters van een kamer te berekenen  Zal kunstmatige koolstofverwijdering de klimaatcrisis helpen oplossen?
Zal kunstmatige koolstofverwijdering de klimaatcrisis helpen oplossen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

