
Wetenschap
Wat zou het kookpunt van methyleenchloride zijn bij 670 mm Hg?
1. Begrijp de relatie
* kookpunt en druk: Het kookpunt van een vloeistof is de temperatuur waarbij de dampdruk gelijk is aan de omliggende atmosferische druk.
* Clausius-Claapeyron-vergelijking: Deze vergelijking relateert dampdruk op temperatuur. We kunnen een vereenvoudigde vorm gebruiken voor kleine temperatuurbereiken:
`` `
ln (p₂/p₁) =- (Δhvap/r) * (1/t₂ - 1/t₁)
`` `
waar:
* P₁ en P₂ zijn de dampdrukken bij temperaturen T₁ en T₂
* Δhvap is de enthalpie van verdamping
* R is de ideale gasconstante (8.314 J/mol · k)
2. Informatie verzamelen
* Normaal kookpunt: Het normale kookpunt van methyleenchloride is 40,1 ° C (313,25 K) bij 760 mmHg (standaarddruk).
* Enthalpie van verdamping (Ahvap): Deze waarde wordt meestal aangetroffen in een referentietabel. Voor methyleenchloride is het ongeveer 29,9 kJ/mol.
3. Stel de vergelijking in
* p₁: 760 mmHg (normaal kookpunt)
* t₁: 313.25 K (normaal kookpunt)
* p₂: 670 mmHg (gegeven druk)
* t₂: Dit is wat we willen vinden (kookpunt op 670 mmHg)
4. Oplossen voor t₂
`` `
ln (670 mmHg/760 mmHg) =- (29,9 kJ/mol/8.314 j/mol · k) * (1/t₂ - 1/313.25 K)
`` `
* Vereenvoudig en los op voor 1/t₂:
`` `
1/t₂ ≈ 0,00318 k⁻¹
`` `
* Bereken t₂:
`` `
T₂ ≈ 314.5 K
`` `
5. Converteren naar Celsius
* T₂ ≈ 314.5 K - 273.15 = 41.35 ° C
Daarom is het kookpunt van methyleenchloride bij 670 mmHg ongeveer 41,35 ° C.
 Wat zijn de drie dingen die Alfred Wegener gebruikte om zijn theorie over Pangea te bewijzen?
Wat zijn de drie dingen die Alfred Wegener gebruikte om zijn theorie over Pangea te bewijzen?  Heeft helium slechts één type atoom?
Heeft helium slechts één type atoom?  Slim antioxidant-bevattend polymeer reageert op lichaamschemie, omgeving
Slim antioxidant-bevattend polymeer reageert op lichaamschemie, omgeving Methoden voor het bepalen van de pH in pH-papier
Methoden voor het bepalen van de pH in pH-papier  Wat is de chemische formule voor magnesiumstikstof?
Wat is de chemische formule voor magnesiumstikstof?
 Drugsvervuiling tegen kanker is een groeiend mondiaal probleem
Drugsvervuiling tegen kanker is een groeiend mondiaal probleem  Wat is het moeilijkste natuurlijke materiaal?
Wat is het moeilijkste natuurlijke materiaal?  De vulkaan Hawaï kan binnenkort zijn top bereiken, slinger stenen en as (update)
De vulkaan Hawaï kan binnenkort zijn top bereiken, slinger stenen en as (update) Welke geografische kenmerken maakten het leven in de vruchtbare halve maan mogelijk?
Welke geografische kenmerken maakten het leven in de vruchtbare halve maan mogelijk?  Hoe bruine ratten van schepen kropen en Noord-Amerikaanse steden veroverden
Hoe bruine ratten van schepen kropen en Noord-Amerikaanse steden veroverden
Hoofdlijnen
- Welke basis in RNA -paar met adenine?
- Welke is oudere wetenschap of tecnologie?
- Wat wordt omgeven door een dubbel membraan en draagt de codering die de eiwitsynthese bepaalt?
- Onderzoekers volgen hoe sporen uit de slapende toestand ontsnappen
- Welke vorm vormt de meeste plasmamembraancellen?
- Wat is de definitie -bacteriën?
- Procedures voor elektroforese van gel
- Onderzoeksartikelen werpen licht op een decennium lang stamcelmysterie
- Wat is de moderne definitie van evolutie op basis van populatiegenetica?
- Nieuwe methode voor het ontwerpen van metabole routes

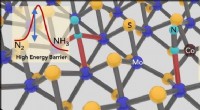
- Ammoniaksynthese gemakkelijk gemaakt met 2D-katalysator
- Deze hydrogeltablet kan een liter rivierwater in een uur zuiveren

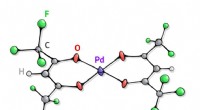
- Chemici versnelden de reactie van vinylsulfiden 10 keer
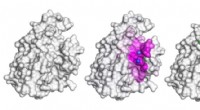
- Neurale netwerk detecteert eiwit-peptide bindingsplaatsen om de ontdekking van peptidegeneesmiddelen op gang te brengen
 Wat maakt het boek de gids voor Galaxy Science Fiction?
Wat maakt het boek de gids voor Galaxy Science Fiction?  Aardbevingsfysica op meerdere schalen
Aardbevingsfysica op meerdere schalen Vrouwelijke pauwspinnen tonen een voorkeur voor multimodale verkering
Vrouwelijke pauwspinnen tonen een voorkeur voor multimodale verkering  Wat is de beste beschrijving of lucht het een samenstelling Een elementmengsel voornamelijk zuurstof en koolstofdioxide?
Wat is de beste beschrijving of lucht het een samenstelling Een elementmengsel voornamelijk zuurstof en koolstofdioxide?  Toekomstige ontmoetingen op de werkplek helpen vertrouwen op te bouwen, dus hoe repliceer je dat online?
Toekomstige ontmoetingen op de werkplek helpen vertrouwen op te bouwen, dus hoe repliceer je dat online? Wat betekent rotatie in het zonnestelsel?
Wat betekent rotatie in het zonnestelsel?  Wanneer de Arctische kust zich terugtrekt, het leven in de ondiepe wateren verandert drastisch
Wanneer de Arctische kust zich terugtrekt, het leven in de ondiepe wateren verandert drastisch Wat houdt water heter papier of piepschuim?
Wat houdt water heter papier of piepschuim?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

