Wetenschap
Hoeveel elektronen kunnen er in de eerste tweede en derde schaal van een atoom gaan?
* eerste shell (n =1): De eerste schaal kan maximaal 2 elektronen bevatten .
* tweede shell (n =2): De tweede schaal kan maximaal 8 elektronen bevatten .
* derde shell (n =3): De derde schaal kan maximaal 18 elektronen bevatten .
Verklaring:
Het aantal elektronen dat een schaal kan bezetten, wordt bepaald door het volgende:
* Hoofdkwantumnummer (n): Dit aantal vertegenwoordigt het energieniveau van de schaal. Hoe hoger de 'n' -waarde, hoe hoger het energieniveau.
* Subshells: Binnen elke schaal zijn er subshells (S, P, D, F) met verschillende vormen en energieniveaus.
* orbitalen: Elke subshell bevat orbitalen, die gebieden van ruimte zijn waar waarschijnlijk elektronen worden gevonden. Elk orbitaal kan maximaal 2 elektronen bevatten.
Hier is een uitsplitsing voor de eerste drie schelpen:
* shell 1 (n =1): Heeft slechts één subschaal, de 's' subshell, die 1 orbitaal bevat. Het kan dus maximaal 2 elektronen bevatten (1 orbitale x 2 elektronen per orbitaal =2 elektronen).
* shell 2 (n =2): Heeft twee subshells:'s' (1 orbital) en 'p' (3 orbitalen). Dit geeft in totaal 4 orbitalen (1 + 3 =4). Daarom kan het maximaal 8 elektronen bevatten (4 orbitalen x 2 elektronen per orbitaal =8 elektronen).
* shell 3 (n =3): Heeft drie subshells:'s' (1 orbital), 'p' (3 orbitalen) en 'd' (5 orbitalen). Dit geeft in totaal 9 orbitalen (1 + 3 + 5 =9). Daarom kan het maximaal 18 elektronen bevatten (9 orbitalen x 2 elektronen per orbitaal =18 elektronen).
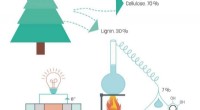
 Op ijzer gebaseerde zonnecellen op weg om efficiënter te worden
Op ijzer gebaseerde zonnecellen op weg om efficiënter te worden Waarom wordt de theoretische opbrengst van een reactie alleen bepaald door de hoeveelheid beperkende reactant?
Waarom wordt de theoretische opbrengst van een reactie alleen bepaald door de hoeveelheid beperkende reactant?  Waar of niet waar? Stoffen met een pH lager dan 7 zijn zuur?
Waar of niet waar? Stoffen met een pH lager dan 7 zijn zuur?  Wat is het woordvergelijking voor reactie tussen zilvernitraat en kaliumbromide?
Wat is het woordvergelijking voor reactie tussen zilvernitraat en kaliumbromide?  Onderzoek met atoomsondetomografie onthult kieren in ijzerkristallen die kunnen genezen
Onderzoek met atoomsondetomografie onthult kieren in ijzerkristallen die kunnen genezen
 Bodemgiftige niveaus zijn meestal gering na Marshall Fire in Boulder, Colorado
Bodemgiftige niveaus zijn meestal gering na Marshall Fire in Boulder, Colorado  Wat is de term die wordt gebruikt om fysieke en culturele kenmerken van de aarde te beschrijven?
Wat is de term die wordt gebruikt om fysieke en culturele kenmerken van de aarde te beschrijven?  Hoe de vloeibaar-aardgasindustrie duurzamer te maken?
Hoe de vloeibaar-aardgasindustrie duurzamer te maken? Wat is het doel van een schaal?
Wat is het doel van een schaal?  Hector verzwakt maar blijft categorie 4 orkaan
Hector verzwakt maar blijft categorie 4 orkaan
Hoofdlijnen
- Wat is een voorbeeld van een parasiet in Afrika?
- Wat zijn de overeenkomsten en verschillen tussen het darwinisme neodarwinisme onderbroken Aquilibrium Panspermia IntelligentDesign?
- Wetenschappers tonen aan dat positief geladen hydrogels de overleving en groei van neurale stamcellen bevorderen
- Hoe genetica en sociale games de evolutie van paringssystemen bij zoogdieren stimuleren
- Waarom is de wetenschappelijke methode gemaakt?
- Waar voeren wetenschappers hun werk uit?
- Waarom zijn Endospores een belangrijke overweging voor de conservenindustrie?
- Laboratoriumtests tonen aan dat het molecuul de celdood in tumoren en ontstekingen lijkt te stimuleren
- Welk orgaansysteem genereert lichaamswarmte en zorgt voor voortbeweging van de geheel?
 Welke veiligheidsregels moeten worden gevolgd in een wetenschappelijk laboratorium bij het wankelen van een onbekende stof?
Welke veiligheidsregels moeten worden gevolgd in een wetenschappelijk laboratorium bij het wankelen van een onbekende stof?  Licht pincet kan bewegen, smelten, en verstrooi mysterieuze biologische ijsbergen
Licht pincet kan bewegen, smelten, en verstrooi mysterieuze biologische ijsbergen Waarom is het veiliger om kalksteen in poedervorm te gebruiken in plaats van calciumhydroxide om zure grond te neutraliseren?
Waarom is het veiliger om kalksteen in poedervorm te gebruiken in plaats van calciumhydroxide om zure grond te neutraliseren?  Wat als Homeostase faalt?
Wat als Homeostase faalt?  Begrijpen hoe motoreiwitten onze cellen vormen
Begrijpen hoe motoreiwitten onze cellen vormen  Justinianuspest geen historische pandemie?
Justinianuspest geen historische pandemie?  Wat is er gebeurd met de dieren van Pompeii na vulkaan?
Wat is er gebeurd met de dieren van Pompeii na vulkaan?  Fotonische technologie maakt realtime berekening van radiosignaalcorrelatie mogelijk
Fotonische technologie maakt realtime berekening van radiosignaalcorrelatie mogelijk
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com