
Wetenschap
Wat is de oxidatietoestand?
Oxidatietoestand:een snelle gids
De oxidatietoestand , ook bekend als oxidatienummer , is een hypothetische lading Dat een atoom zou hebben als al zijn obligaties 100% ionisch waren. Het is een manier om elektronentransfers bij te houden in chemische reacties, en het helpt ons te begrijpen:
* Redox -reacties: Reacties waarbij elektronen van de ene soort naar de andere worden overgebracht.
* chemische binding: Hoe atomen elektronen delen of overbrengen om bindingen te vormen.
Hier is een uitsplitsing:
* regels om de oxidatietoestand te bepalen:
* gratis elementen: Een atoom in zijn elementaire vorm heeft een oxidatietoestand van 0. (bijv. NA, CL2, O2)
* Monatomische ionen: De oxidatietoestand van een monatomisch ion is gelijk aan zijn lading. (bijv. Na + =+1, Cl- =-1)
* zuurstof: Heeft meestal een oxidatietoestand van -2, behalve in peroxiden (O2^-2) waar het -1 is.
* waterstof: Heeft meestal een oxidatietoestand van +1, behalve in metaalhydriden (bijv. NAH) waar het -1 is.
* fluor: Heeft altijd een oxidatietoestand van -1.
* som van oxidatietoestanden: De som van oxidatietoestanden in een neutrale verbinding is altijd 0.
* som van oxidatietoestanden in een polyatomisch ion: De som van oxidatietoestanden is gelijk aan de lading van het ion.
* oxidatie en reductie:
* oxidatie: Wanneer een atoom elektronen verliest, neemt de oxidatietoestand toe.
* reductie: Wanneer een atoom elektronen krijgt, neemt de oxidatietoestand af.
Voorbeelden:
* In NaCl , natrium (NA) heeft een oxidatietoestand van +1 en chloor (CL) heeft een oxidatietoestand van -1.
* In h2o , waterstof (H) heeft een oxidatietoestand van +1 en zuurstof (O) heeft een oxidatietoestand van -2.
* In SO4^2- , zwavel (s) heeft een oxidatietoestand van +6 en zuurstof (O) heeft een oxidatietoestand van -2.
Sleutelpunten:
* De oxidatietoestand is een theoretisch concept, geen daadwerkelijke lading.
* Het is een nuttig hulpmiddel voor het voorspellen en begrijpen van chemische reacties.
* Het helpt ons te identificeren welke soort wordt geoxideerd en welke wordt verminderd in een redoxreactie.
Laat het me weten als je specifieke voorbeelden hebt die je zou willen doorwerken!
 Bij kamertemperatuur is tafel zout een vaste en kwikvloeistof welke conclusie kun je trekken over de smelpunten van deze stoffen?
Bij kamertemperatuur is tafel zout een vaste en kwikvloeistof welke conclusie kun je trekken over de smelpunten van deze stoffen?  Hoe werkt een chemisch warmtepakket?
Hoe werkt een chemisch warmtepakket?  Waarom zijn planten groen? Model van onderzoeksteams reproduceert fotosynthese
Waarom zijn planten groen? Model van onderzoeksteams reproduceert fotosynthese Is vaste jodiumsublimes in paarse damp een fysische of chemische verandering?
Is vaste jodiumsublimes in paarse damp een fysische of chemische verandering?  Onderzoekers creëren een eiwitmat die vervuiling kan absorberen
Onderzoekers creëren een eiwitmat die vervuiling kan absorberen
 Hoe kwamen veranderende ideeën over de rol van individuele invloeden op de manier waarop wetenschappers de fysieke wereld begonnen te begrijpen?
Hoe kwamen veranderende ideeën over de rol van individuele invloeden op de manier waarop wetenschappers de fysieke wereld begonnen te begrijpen?  Als we zien dat voedsel wordt verspild, worden we gek - maar zou dat ook moeten?
Als we zien dat voedsel wordt verspild, worden we gek - maar zou dat ook moeten? Michigans suiker esdoorns zullen worstelen in een warmer, drogere toekomst ondanks hulp van stikstofvervuiling
Michigans suiker esdoorns zullen worstelen in een warmer, drogere toekomst ondanks hulp van stikstofvervuiling Vier grootste verschillen tussen de oceaan en zoet water
Vier grootste verschillen tussen de oceaan en zoet water  Wat is het Keltische woord voor planeet?
Wat is het Keltische woord voor planeet?
Hoofdlijnen
- Nieuw AI-systeem kan het gedrag van fruitvliegjes decoderen:waarom dat cruciaal is voor toekomstig onderzoek naar de menselijke genetica
- Waarom is het zo moeilijk voor mensen om een baby te krijgen?
- Wie kan profiteren van klimaatverandering? Ratelslangen, suggereert onderzoek
- Wat doet mitochondriën in een zenuwcel?
- Wie patenteert wiens genoom?
- Wanneer cellen veranderen om verschillende soorten van dat te worden, doen dat banen?
- De mannelijke reproductieve structuur van niet -vasculaire planten wordt genoemd?
- Wat is de officiële naam van de kleinste en eenvoudigste cellen?
- Wat heeft de Griekse wetenschapper Aristarchus ontwikkeld?
- Doorbraak naar het oplossen van het structurele mysterie van glas
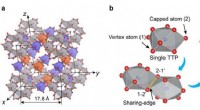
- Traditionele geheimen om koel te blijven - onderzoek naar Okinawa-textiel

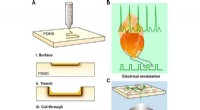
- Laserschrijven van met stikstof gedoteerd siliciumcarbide voor biologische modulatie
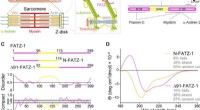
- Orde van wanorde in de sarcomeer
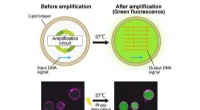
- Nieuwe DNA-amplificatiecapsule belooft veel voor de bestrijding van ziekten
 Terugtocht van Noorse ijsvlakte onthult verloren Viking-artefacten in bergpas
Terugtocht van Noorse ijsvlakte onthult verloren Viking-artefacten in bergpas Wat is serendipity en hoe heeft het betrekking op de wetenschap?
Wat is serendipity en hoe heeft het betrekking op de wetenschap?  Onderzoek naar het potentieel van katalysatoren met één atoom
Onderzoek naar het potentieel van katalysatoren met één atoom  De magnetische singulariteit naderen
De magnetische singulariteit naderen Exotische faseovergangen ontgrendelen paden naar op superfluïde gebaseerde technologieën
Exotische faseovergangen ontgrendelen paden naar op superfluïde gebaseerde technologieën Snelle vernietiging van aardachtige atmosferen door jonge sterren
Snelle vernietiging van aardachtige atmosferen door jonge sterren Inlichtingenonderzoek ID's sleutelfactoren voor overheid, academische wereld, samenwerking in de industrie
Inlichtingenonderzoek ID's sleutelfactoren voor overheid, academische wereld, samenwerking in de industrie Wat is het belang van verwering in de geomorfologie?
Wat is het belang van verwering in de geomorfologie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

