
Wetenschap
Hoe werkt de pH -schaal?
* 0 tot 6.9: Zure oplossingen
* 7: Neutrale oplossingen (zoals zuiver water)
* 7.1 tot 14: Alkalische (of basale) oplossingen
Hier is hoe het werkt:
1. De rol van waterstofionen:
* Zuurgraad en alkaliteit worden bepaald door de concentratie van waterstofionen (H+) in een oplossing.
* Hoe meer h+ ionen aanwezig zijn, hoe zure de oplossing.
* Hoe minder H+ ionen aanwezig zijn, hoe meer alkalisch de oplossing.
2. De pH -schaal is logaritmisch:
* De pH -schaal is logaritmisch, wat betekent dat elke gehele getalverandering een tienvoudige verandering in H+ -concentratie vertegenwoordigt.
* Een pH van 5 is bijvoorbeeld tien keer zuurder dan een pH van 6 en honderd keer meer zuur dan een pH van 7.
3. PH meten:
* pH kan worden gemeten met behulp van:
* pH -indicatoren: Chemicaliën die van kleur veranderen, afhankelijk van de zuurgraad of alkaliteit van de oplossing. Lakmuspapier is een veel voorkomend voorbeeld.
* pH -meters: Elektronische apparaten die de elektrische potentiaal van een oplossing meten, die gerelateerd is aan de pH.
Hier is een vereenvoudigde analogie:
Stel je een zwembad voor. De pH -schaal is als de diepte van het zwembad.
* Een lage pH (zoals 2) is als een zeer ondiep einde - er zijn veel waterstofionen (zoals veel water) in een kleine ruimte.
* Een hoge pH (zoals 12) is als het diepe einde - er zijn maar weinig waterstofionen (zoals heel weinig water) in een grote ruimte.
* Een neutrale pH (zoals 7) is als het midden van het zwembad - er is een evenwichtige hoeveelheid waterstofionen.
Belang van pH:
* PH speelt een cruciale rol in veel natuurlijke processen en in ons dagelijks leven.
* Onze lichamen handhaven een specifiek pH -bereik voor een optimale functie.
* Planten en dieren hebben specifieke pH -vereisten om te overleven.
* PH is belangrijk in veel industrieën, waaronder landbouw, productie en voedselverwerking.
Laat het me weten als je je wilt verdiepen in meer specifieke voorbeelden of toepassingen van pH!
 Wat zijn twee kenmerken van levende wezens?
Wat zijn twee kenmerken van levende wezens?  Een van Europa's ergste hongersnoden, waarschijnlijk veroorzaakt door verwoestende overstromingen
Een van Europa's ergste hongersnoden, waarschijnlijk veroorzaakt door verwoestende overstromingen Is het waar dat het leren over de natuurlijke wereld begint met het onthouden van wetenschappelijke wetten en theorieën?
Is het waar dat het leren over de natuurlijke wereld begint met het onthouden van wetenschappelijke wetten en theorieën?  De ontbrekende massa - wat veroorzaakt een geoïde laag in de Indische Oceaan?
De ontbrekende massa - wat veroorzaakt een geoïde laag in de Indische Oceaan? De rotsachtige weg naar nauwkeurige voorspellingen van de zeespiegel
De rotsachtige weg naar nauwkeurige voorspellingen van de zeespiegel
Hoofdlijnen
- Waar komt genectische variatie vandaan?
- Hoe de uitvinding van de microscoop wetenschappers hielp cellen te begrijpen?
- Geurende reinigingsproducten: The New Smoking?
- Vergroening van citrusvruchten behandelen met koper:effecten op bomen, bodems
- Wat is een maat voor de organismen van het aantal variëteiten en de amp -variabiliteit in een ecosysteem?
- Onderzoekers onthullen hoe genetisch identieke watervlooien zich ontwikkelen tot verschillende geslachten
- Wat is een gras? Chloroplast-DNA laat zien dat gras dat misschien niet is
- Welk gebied produceert cellen in een plant?
- Een modelhart maken met materialen uit uw huis
- Onderzoekers ontwikkelen betere methode om giftige kleurstoffen uit afvalwater te verwijderen

- Biochemicus ontdekt veelbelovend enzym om kankercellen te bestrijden
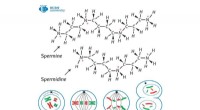
- Water + lucht + elektriciteit =waterstofperoxide

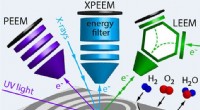
- Drie microscopen zien meer dan twee
- Oorsprong van het leven:chemische evolutie in een kleine Golfstroom

 Wat zijn de laboratoriumapparatuur en een beeld geven?
Wat zijn de laboratoriumapparatuur en een beeld geven?  Wie was een middeleeuwse wetenschapper?
Wie was een middeleeuwse wetenschapper?  Wat is de breedste planeet?
Wat is de breedste planeet?  Amerikaanse autoriteiten pakken StarKist op in ingeblikt tonijnschandaal
Amerikaanse autoriteiten pakken StarKist op in ingeblikt tonijnschandaal Elektrolyt zijn meestal samengesteld uit wat?
Elektrolyt zijn meestal samengesteld uit wat?  Differentiate fysische chemie naar andere tak van chemie?
Differentiate fysische chemie naar andere tak van chemie?  Een 5G-standaardknipoog wint vertrouwen als essentiële stap naar primetime
Een 5G-standaardknipoog wint vertrouwen als essentiële stap naar primetime Nieuw-Zeelandse leider zegt geen definitieve beslissing over het gebruik van Huawei
Nieuw-Zeelandse leider zegt geen definitieve beslissing over het gebruik van Huawei
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

