
Wetenschap
Wat is de samenstelling met overdracht van elektron een metaalelement en niet -element?
* elektronenoverdracht: Ionische verbindingen vormen zich wanneer een metaalatoom elektronen verliest (een positief geladen ionen worden - een kation) en een niet -metaal atoom krijgt die elektronen (een negatief geladen ionen worden - een anion). Deze overdracht van elektronen creëert een elektrostatische aantrekkingskracht tussen de tegengesteld geladen ionen.
* metaal en niet -metaal: Metalen verliezen de neiging om elektronen gemakkelijk te verliezen vanwege hun lage elektronegativiteit, terwijl niet -metalen een hoge elektronegativiteit hebben en gemakkelijk elektronen krijgen.
Voorbeelden van ionische verbindingen:
* Natriumchloride (NaCl): Natrium (NA, een metaal) verliest een elektron om Na+te worden, en chloor (CL, een niet-metaal) krijgt een elektron om Cl- te worden. De resulterende ionen trekken elkaar aan om de verbinding te vormen.
* magnesiumoxide (MGO): Magnesium (mg, een metaal) verliest twee elektronen om mg2+te worden, en zuurstof (O, een niet-metaal) krijgt twee elektronen om O2- te worden.
Key -kenmerken van ionische verbindingen:
* Hoog smelten- en kookpunten: De sterke elektrostatische krachten tussen ionen vereisen veel energie om te breken.
* vast bij kamertemperatuur: De sterke krachten houden de ionen star in een kristalrooster.
* Ledel elektriciteit wanneer gesmolten of opgelost: Het vrije verkeer van ionen zorgt voor de geleiding van elektriciteit.
* vaak oplosbaar in water: De polaire watermoleculen kunnen interageren met de geladen ionen en het ionische rooster uiteenvallen.
Laat het me weten als je nog andere vragen hebt!
 Hoe planten salicylzuur synthetiseren
Hoe planten salicylzuur synthetiseren  Hoe laat een chemische vergelijking zien dat er reactie is opgetreden?
Hoe laat een chemische vergelijking zien dat er reactie is opgetreden?  Geminiaturiseerde neuroprobe voor het nemen van monsters van neurotransmitters in de hersenen
Geminiaturiseerde neuroprobe voor het nemen van monsters van neurotransmitters in de hersenen Hoe inerte verbindingen ionen kunnen stelen
Hoe inerte verbindingen ionen kunnen stelen Nieuwe technologie biedt opwindende inzichten in hoe katalysatoren op atomair niveau werken
Nieuwe technologie biedt opwindende inzichten in hoe katalysatoren op atomair niveau werken
 Waarom is General Sherman Tree in Sequoia National Park beroemd?
Waarom is General Sherman Tree in Sequoia National Park beroemd?  Wetenschappers voeren eerste in situ stralingsmetingen uit op 21 km in de lucht boven het Tibetaanse plateau
Wetenschappers voeren eerste in situ stralingsmetingen uit op 21 km in de lucht boven het Tibetaanse plateau Dringende noodzaak om langetermijneffecten van extreem weer op de gezondheid aan te pakken
Dringende noodzaak om langetermijneffecten van extreem weer op de gezondheid aan te pakken Waarom is de wetenschap een superieure bron van kennis in vergelijking met traditie ervaren gezond verstand?
Waarom is de wetenschap een superieure bron van kennis in vergelijking met traditie ervaren gezond verstand?  Zacht weefsel maakt koraal taaier in het licht van klimaatverandering
Zacht weefsel maakt koraal taaier in het licht van klimaatverandering
Hoofdlijnen
- De oppervlakte van een cirkel berekenen
- Is het waar dat om de gewenste kenmerken van een lijnorganismen te handhaven, fokkers vaak hybridisatie gebruiken?
- Hoe zijn wetenschapstechnologie en samenleving allemaal gerelateerd?
- Wat zijn de overeenkomsten en verschillen tussen het darwinisme neodarwinisme onderbroken Aquilibrium Panspermia IntelligentDesign?
- Onderzoekers stellen vast dat jaarlijks grote aantallen wilde berggeiten door lawines worden gedood
- Onderzoek details genetische resistentie tegen plotselinge dood syndroom in sojabonen
- Nation-building of natuurvernietiging? Waarom het tijd is dat NZ de milieuschade van het koloniale verleden het hoofd moet bieden
- Wat zijn koolhydraten en hun functie?
- Onderzoekers vinden aanwijzingen om te verduidelijken waarom cohesine een rol speelt bij kanker en de ontwikkeling van het hart
- Gebouwen – Beton op de dubbele

- Lab produceert eenvoudige fluorescerende oppervlakteactieve stoffen
- Elektrochemische synthese van formiaat uit koolstofdioxide met behulp van een tin/gereduceerde grafeenoxidekatalysator

- Metalen nanodeeltjes verlichten een andere weg naar milieuvriendelijke katalysatoren
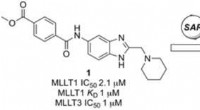
- Ontdekking van selectieve chemische probes die epigenetische factoren voor acute myeloïde leukemie remmen
 Hoe luchtvaartpersoneel werkt
Hoe luchtvaartpersoneel werkt  's Werelds eerste commerciële nanogestructureerde bulkmetaal
's Werelds eerste commerciële nanogestructureerde bulkmetaal Kunnen we donkere energie dumpen door de algemene relativiteitstheorie beter te begrijpen?
Kunnen we donkere energie dumpen door de algemene relativiteitstheorie beter te begrijpen? Welk type binding zal zich vormen tussen barium en zuurstof?
Welk type binding zal zich vormen tussen barium en zuurstof?  Welk type moleculen komen ten minste drie binnen de cel via passieve transportlijst?
Welk type moleculen komen ten minste drie binnen de cel via passieve transportlijst?  Hoe kunnen polymeren worden gebruikt in optische materialen?
Hoe kunnen polymeren worden gebruikt in optische materialen?  'Het doet je twijfelen aan je identiteit':wat het betekent voor Latino's om de Spaanse spreekvaardigheid te verliezen
'Het doet je twijfelen aan je identiteit':wat het betekent voor Latino's om de Spaanse spreekvaardigheid te verliezen  Engineering enzymen om plantaardig afval om te zetten in duurzame producten
Engineering enzymen om plantaardig afval om te zetten in duurzame producten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

