
Wetenschap
Wat is de hybridisatie van centraal atoom in HSEO3-?
1. Teken de Lewis -structuur:
* Tel valentie -elektronen: H (1) + S (6) + O (3 * 6) + 1 (negatieve lading) =26 valentie -elektronen.
* Verbind atomen: Plaats zwavel (en) in het midden, omgeven door drie oxygens (O). Sluit elke zuurstof aan op zwavel met een enkele binding.
* Voltooi octetten: Plaats alleenstaande paren op de zuurstofatomen om hun octetten te voltooien.
* Voeg de waterstof toe: Plaats de waterstof op een van de zuurstofatomen.
* Controleer op formele kosten: Het zwavelatoom moet een formele lading van +1 hebben en een van de zuurstofatomen moet een formele lading van -1 hebben. Dit is de meest stabiele regeling.
2. Tel elektrondomeinen:
* Elektronendomeinen: Dit zijn gebieden met elektronendichtheid rond het centrale atoom. In HSO₃⁻ heeft zwavel vier elektrondomeinen:
* Drie enkele bindingen aan zuurstofatomen
* Eén dubbele binding aan een zuurstofatoom
3. Hybridisatie bepalen:
* Hybridisatie: De hybridisatie van een atoom wordt bepaald door het aantal elektronendomeinen eromheen.
* Vier elektrondomeinen =SP³ hybridisatie
Daarom is de hybridisatie van het centrale zwavelatoom in HSO₃⁻ Sp³
 De activeringssynthesetheorie zegt dat:(Apex)?
De activeringssynthesetheorie zegt dat:(Apex)?  Ultrakleine, vormveranderende GEMS bieden een eenvoudiger en goedkopere manier om MRI-beeldvorming te verbeteren
Ultrakleine, vormveranderende GEMS bieden een eenvoudiger en goedkopere manier om MRI-beeldvorming te verbeteren  Hoe maak je een model van de moleculaire structuur van Water
Hoe maak je een model van de moleculaire structuur van Water Gekleurde stoffen die worden gebruikt om andere materialen te kleuren die worden genoemd?
Gekleurde stoffen die worden gebruikt om andere materialen te kleuren die worden genoemd?  Hoeveel waterstof zal produceren als u zwavelzuur mengt met calciummetaal?
Hoeveel waterstof zal produceren als u zwavelzuur mengt met calciummetaal?
 Veel boeren hebben nog training nodig na Lake Erie-algen
Veel boeren hebben nog training nodig na Lake Erie-algen Hoe reproduceert kroos zich?
Hoe reproduceert kroos zich?  How to Make Squirrel Food
How to Make Squirrel Food Het vervangen van sommige oude leidingen kan nog steeds leiden tot met lood verontreinigd water
Het vervangen van sommige oude leidingen kan nog steeds leiden tot met lood verontreinigd water De verouderende waterinfrastructuur in het Zuiden wordt getroffen door de klimaatverandering. Het oplossen ervan is ook een strijd
De verouderende waterinfrastructuur in het Zuiden wordt getroffen door de klimaatverandering. Het oplossen ervan is ook een strijd
Hoofdlijnen
- Waar groeit planten vandaan?
- Methode maakt inzichtelijk wat bacteriën in hun omgeving waarnemen
- Wat zijn de organellen in plantencellen die energie van zonlicht veranderen in voedsel?
- Het verhaal van de paarse tomaat – en waarom het succes ervan een overwinning is voor genetisch gemodificeerd voedsel
- Welke organelfunctie in eukaryotische cellulaire ademhaling waarin ATP wordt geproduceerd?
- Wat zijn kleine organen die specifieke functies in de cel uitvoeren?
- Hebben hersencellen een lipide-dubbellaag?
- Waarom was de ontwikkeling van microscoop belangrijk om cellen te ontdekken?
- Wat zijn coliforme bacteriën?
- Nieuwe methode gebruikt kunstmatige intelligentie om levende cellen te bestuderen
- Gevoelige nieuwe test detecteert antilichamen tegen SARS-CoV-2 in slechts 10 minuten

- Gemodificeerd kankermedicijn effectief tegen multiresistente bacteriën
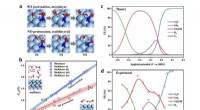
- Wetenschappers onthullen potentiële afhankelijkheid van elektroreductie van stikstofmonoxide tot ammoniak
- Op maat gemaakte molecule is veelbelovend als antikankertherapie
 Wat is de dichtheid van gallium als aluminium een dichtheid van 2,70 gcm3 heeft en boor 2,08 gcm3?
Wat is de dichtheid van gallium als aluminium een dichtheid van 2,70 gcm3 heeft en boor 2,08 gcm3?  Welk deel van de stamcellen biedt instructies om het hart te bouwen?
Welk deel van de stamcellen biedt instructies om het hart te bouwen?  Wat is de belangrijkste functie van een volwassen sporofyt?
Wat is de belangrijkste functie van een volwassen sporofyt?  Diep, oud water verklaart waarom de Antarctische Oceaan niet is opgewarmd
Diep, oud water verklaart waarom de Antarctische Oceaan niet is opgewarmd  Een object blijft in rust of bewegen in een rechte lijn met constante snelheid, tenzij het wordt gehandeld op kracht dit de definitie van Newtons eerste wet Wat?
Een object blijft in rust of bewegen in een rechte lijn met constante snelheid, tenzij het wordt gehandeld op kracht dit de definitie van Newtons eerste wet Wat?  Elektronen uit waterstof opslaan voor schone chemische reacties
Elektronen uit waterstof opslaan voor schone chemische reacties  Gadgets:Na een dag grillen, laat een robot voor het schoonmaken zorgen
Gadgets:Na een dag grillen, laat een robot voor het schoonmaken zorgen Kleine koolstofnanobuisjes vertonen een groot kiembestrijdend potentieel
Kleine koolstofnanobuisjes vertonen een groot kiembestrijdend potentieel
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

