
Wetenschap
Wat gebeurt er met de snelheid van een chemische reactie wanneer katalysator aanwezig is?
* Activeringsenergie verlagen: Katalysatoren bieden een alternatieve reactieroute met een lagere activeringsenergie. Dit betekent dat er minder energie nodig is voor de reactanten om de overgangstoestand te bereiken en producten te vormen.
* het verhogen van de reactiesnelheid: Door de activeringsenergie te verlagen, laten katalysatoren meer reactantmoleculen toe om de energiebarrière te overwinnen en te reageren, wat leidt tot een snellere reactiesnelheid.
Zie het zo:stel je een bergpas voor. De reactanten moeten de berg beklimmen om de productzijde te bereiken. Een katalysator is als het bouwen van een tunnel door de berg, waardoor het veel gemakkelijker en sneller wordt voor de reactanten om naar de andere kant te komen.
belangrijke punten:
* Katalysatoren worden niet geconsumeerd in de reactie. Ze nemen deel aan de reactie maar worden aan het einde geregenereerd.
* Katalysatoren kunnen specifiek zijn voor bepaalde reacties en kunnen in verschillende vormen worden gebruikt (vaste stoffen, vloeistoffen, gassen).
* De aanwezigheid van een katalysator verandert de evenwichtsconstante (k) van een reactie niet. Het helpt de reactie eenvoudigweg het evenwicht te bereiken sneller.
Voorbeelden van katalysatoren:
* enzymen: Biologische katalysatoren die biochemische reacties in levende organismen versnellen.
* metalen katalysatoren: Gebruikt in veel industriële processen, zoals de productie van benzine en kunststoffen.
* zure katalysatoren: Gebruikt in veel organische reacties, zoals verestering.
Samenvattend zijn katalysatoren krachtige hulpmiddelen die de snelheid van chemische reacties aanzienlijk kunnen verhogen. Ze zijn essentieel in veel industriële en biologische processen.
 Wat gebeurt er met de deeltjes in een stof tijdens het smelten?
Wat gebeurt er met de deeltjes in een stof tijdens het smelten?  Heeft u fundamentele grootheden gedifferentieerd en grootheden afgeleid?
Heeft u fundamentele grootheden gedifferentieerd en grootheden afgeleid?  Wat is de formule voor hyposulfiet?
Wat is de formule voor hyposulfiet?  Onderzoekers melden doorbraak in ijsafstotende materialen
Onderzoekers melden doorbraak in ijsafstotende materialen Materialen door welke warmte kan gemakkelijk stromen worden opgeroepen?
Materialen door welke warmte kan gemakkelijk stromen worden opgeroepen?
 Klimaatverandering heeft nu al invloed op de wereldwijde voedselproductie - ongelijk
Klimaatverandering heeft nu al invloed op de wereldwijde voedselproductie - ongelijk Voorbeelden van indicatorensoorten
Voorbeelden van indicatorensoorten Onderzoek suggereert dat het eten van bonen in plaats van rundvlees de broeikasgassen sterk zou verminderen
Onderzoek suggereert dat het eten van bonen in plaats van rundvlees de broeikasgassen sterk zou verminderen Werelderfgoedlocaties bedreigd door zeespiegelstijging
Werelderfgoedlocaties bedreigd door zeespiegelstijging Hoe worden groenblijvende bomen aangepast aan koud klimaat?
Hoe worden groenblijvende bomen aangepast aan koud klimaat?
Hoofdlijnen
- Hoe het brein leert zien
- Welke soort heeft de grootste testikels? Groot geheim onthuld door onderzoekers
- Uit afvalwatermodellering van landbouwbedrijven blijkt dat voetbaden een bron van antimicrobiële resistentie zijn
- Krokodillentranen? Onderzoeksresultaten kunnen helpen de populatieomvang van bedreigde diersoorten te vergroten
- Wat zijn de eigenschappen van Aliguyon?
- Wat is de modellering van fylogenie A -soort?
- Wat zijn voor belangrijke soorten lymfocyten?
- Door hoeveel hartkleppen moet een bloedcel passeren terwijl deze van de hersenen naar longen beweegt?
- Pizza-nachtmerries:kan uw dieet uw dromen bepalen?
- Een vetregulerend enzym kan de sleutel zijn tot obesitas, suikerziekte, kanker, andere ziekten
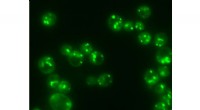
- Xenon verbetert de eigenschappen van maxillofaciale en orthopedische implantaten

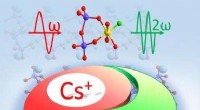
- Onderzoek onthult het eerste niet-centrosymmetrische fluoroxosilicofosfaat met Si-F-bindingen
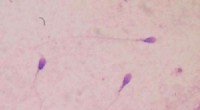
- Laat de spermaraces beginnen
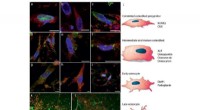
- Onderzoekers kweken het meest levensechte bot tot nu toe uit geweven cellen
 Wanneer erodeert stoom sedimenten?
Wanneer erodeert stoom sedimenten?  Hoeveel mol chloorgas bevindt zich in 9.02x1023 moleculen?
Hoeveel mol chloorgas bevindt zich in 9.02x1023 moleculen?  De positieve kanten van klimaatverandering? Onderzoek toont agrarische, economische mogelijkheden
De positieve kanten van klimaatverandering? Onderzoek toont agrarische, economische mogelijkheden  Waarom blijven moderne astronomen de hemelse sfeer gebruiken als ze weten dat sterren niet allemaal op dezelfde afstand zijn?
Waarom blijven moderne astronomen de hemelse sfeer gebruiken als ze weten dat sterren niet allemaal op dezelfde afstand zijn?  Sneller giftige kankerverwekkende metalen vinden in voedsel en water
Sneller giftige kankerverwekkende metalen vinden in voedsel en water Hoe worden de ertsafzettingen verwijderd bij schacht- en stripmijnbouw, vergelijkbaar met dagbouw?
Hoe worden de ertsafzettingen verwijderd bij schacht- en stripmijnbouw, vergelijkbaar met dagbouw?  Effect van fotochemische smog
Effect van fotochemische smog  Langzame aardbevingen komen continu voor in de subductiezone van Alaska-Aleutian
Langzame aardbevingen komen continu voor in de subductiezone van Alaska-Aleutian
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

