
Wetenschap
Bepaal de druk die wordt uitgeoefend door 1,80 mol gas in een 2,92 container bij 32,0 ° C?
1. Converteer de temperatuur naar Kelvin
* De ideale gaswet vereist temperatuur in Kelvin.
* K =° C + 273.15
* K =32.0 ° C + 273.15 =305.15 K
2. Ideale gaswet
* De ideale gaswet is:PV =nrt
* P =druk (in atmosferen, atm)
* V =volume (in liters, l)
* n =aantal mol
* R =ideale gasconstante (0,0821 l⋅atm/mol⋅k)
* T =temperatuur (in Kelvin, K)
3. Oplossen voor druk (P)
* Herschik de ideale gaswet om op te lossen voor P:
* P =(nrt) / v
4. Sluit de waarden aan aan
* P =(1,80 mol * 0,0821 l⋅atm / mol⋅K * 305.15 k) / 2,92 l
5. Bereken de druk
* P ≈ 15.3 ATM
Daarom is de druk die door het gas wordt uitgeoefend ongeveer 15,3 atmosferen.
 Wat is de molaire massa van berylliumchloride BECL2?
Wat is de molaire massa van berylliumchloride BECL2?  Wat zijn de 3 basisgebeurtenissen van lichte onafhankelijke reacties?
Wat zijn de 3 basisgebeurtenissen van lichte onafhankelijke reacties?  Hoe toon je aan dat broomatomen aanwezig zijn in broomalkaan?
Hoe toon je aan dat broomatomen aanwezig zijn in broomalkaan?  Van twee kanten naar moleculen kijken met femtoseconde zachte röntgenstralen op tafel
Van twee kanten naar moleculen kijken met femtoseconde zachte röntgenstralen op tafel Waar bevinden de subatomaire deeltjes zich in atomen?
Waar bevinden de subatomaire deeltjes zich in atomen?
 Europa houdt klimaatverandering vanuit de ruimte in de gaten
Europa houdt klimaatverandering vanuit de ruimte in de gaten Maleisië dringt bij EU aan op gepland verbod op palmolie in biobrandstoffen
Maleisië dringt bij EU aan op gepland verbod op palmolie in biobrandstoffen Waarom je bijna zeker tijd verspilt aan het spoelen van je recycling?
Waarom je bijna zeker tijd verspilt aan het spoelen van je recycling? Video:SMOS 10 jaar in een baan om de aarde
Video:SMOS 10 jaar in een baan om de aarde Mestinjectie biedt hoop, uitdaging voor het herstellen van de waterkwaliteit van Chesapeake
Mestinjectie biedt hoop, uitdaging voor het herstellen van de waterkwaliteit van Chesapeake
Hoofdlijnen
- Wat zijn de kleine organen die chemische reacties en functies uitvoeren in celroepen?
- Vrijvormende organellen helpen planten zich aan te passen aan de klimaatverandering
- Wat zijn verschillende soorten laboratoriumapparatuur en hun betekenis?
- Hoe erfelijke ziekten werken
- Een genetische eigenschap die aanwezig is maar ongezien in een persoon die een eigenschap wordt genoemd?
- Transformatie, transductie en vervoeging: gentransfer in Prokaryotes
- Biologen onderzoeken wat er gebeurt als eigenschappen tussen takken van de boom springen
- Nieuw onderzoek onthult wat pinguïns eten
- Wat betekent het als menselijk DNA vergelijkbaar is met chimpansee -DNA?
- De overeenkomsten tussen een schilderij van Van Gogh en een golfbal

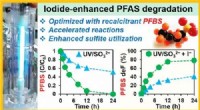
- PFAS-chemicaliën gaan niet eeuwig mee
- Onderzoekers bedenken kleine, hersluitbare pakketten om materialen op tijd af te leveren

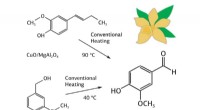
- Chemicus maakt goedkope katalysatoren voor de productie van vanilline
- Team ontwikkelt nieuwe halfgeleiderverwerkingstechnologie

 Hoe meet je de conversie
Hoe meet je de conversie Een toekomst van behulpzame engineered living machines?
Een toekomst van behulpzame engineered living machines? Wat is de term voor een vaste vorm wanneer twee oplossingen worden gemengd?
Wat is de term voor een vaste vorm wanneer twee oplossingen worden gemengd?  Hoe benzine werkt
Hoe benzine werkt  Een grote opknapbeurt van SNAP zou de voedselonzekerheid in de VS kunnen wegnemen
Een grote opknapbeurt van SNAP zou de voedselonzekerheid in de VS kunnen wegnemen Flexibel, draagbare röntgendetector vereist geen zware metalen
Flexibel, draagbare röntgendetector vereist geen zware metalen Machine learning versnellen door middel van licht
Machine learning versnellen door middel van licht Wiskundig model voorspelt menselijke mobiliteit als reactie op stormen en pandemieën
Wiskundig model voorspelt menselijke mobiliteit als reactie op stormen en pandemieën
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

