
Wetenschap
Hoe berekent u de concentratie van de waterstofionen van pH 6,2?
Hier leest u hoe u de waterstofionconcentratie ([H+]) kunt berekenen van een pH van 6,2:
Inzicht in de relatie
* pH is een maat voor de zuurgraad of alkaliteit van een oplossing. Het wordt gedefinieerd als de negatieve logaritme (basis 10) van de concentratie waterstofionen:
pH =-log [H+]
* [H+] is de waterstofionconcentratie, tot expressie gebracht in mol per liter (mol/L).
Berekening
1. herschik de pH -vergelijking om op te lossen voor [H+]:
[H+] =10^(-pH)
2. Vervang de gegeven pH -waarde:
[H+] =10^(-6.2)
3. Bereken met behulp van een rekenmachine:
[H+] ≈ 6.31 x 10^-7 mol/l
Daarom is de waterstofionconcentratie van een oplossing met een pH van 6,2 ongeveer 6,31 x 10^-7 mol/l.
 Nieuwe studie onderzoekt federale buyouts van huiseigenaren
Nieuwe studie onderzoekt federale buyouts van huiseigenaren Tweederde van tropische bossen bedreigd in volgend decennium
Tweederde van tropische bossen bedreigd in volgend decennium Lijst van natuurlijke hulpbronnen in Washington, D.C.
Lijst van natuurlijke hulpbronnen in Washington, D.C.  Red de bomen:eindeloze constructie in steden bedreigt het stadsbos
Red de bomen:eindeloze constructie in steden bedreigt het stadsbos NASA ziet tyfoon Noru met grote ogen op weg naar de aanlanding in Kyushu, Japan
NASA ziet tyfoon Noru met grote ogen op weg naar de aanlanding in Kyushu, Japan
Hoofdlijnen
- Welke voedingsstoffen hebben planten nodig als ze geelachtig groen zijn?
- Welke schadelijke effecten hebben sommige bacteriën op mensen?
- Antibioticaresistentie:slapende bacteriën die medicamenteuze behandeling kunnen overleven geïdentificeerd
- Veelkleurige planten zijn ineens een must-have in je interieur. Zo houd je ze in leven
- Nieuwe tool decodeert complexe genomische gegevens van één cel
- Is de weide knoflookbloem multi-cellulair of eencellulair?
- Welke suiker componeert een deel van het ATP -molecuul?
- De vier eigenschappen van spiercellen
- In welke tak van de wetenschap is gelotologie?
- Kleine implantaten voor cellen zijn functioneel in vivo
- Microben maken die broeikasgassen transformeren

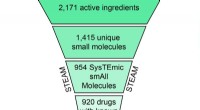
- EEN WOLK aan mogelijkheden:nieuwe therapieën vinden door medicijnen te combineren
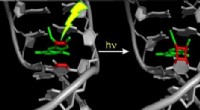
- Licht werpen op het reactiemechanisme van PUVA-lichttherapie voor huidziekten
- Wetenschappers creëren nieuwe aluminiumlegering met flexibiliteit, kracht, lichtheid

 Een holle metalen bol heeft een grote negatieve lading op de elektrische veldsterkte binnen de IS?
Een holle metalen bol heeft een grote negatieve lading op de elektrische veldsterkte binnen de IS?  Profilering van extreme bundels:wetenschappers bedenken nieuwe diagnostiek voor geavanceerde en next-gen deeltjesversnellers
Profilering van extreme bundels:wetenschappers bedenken nieuwe diagnostiek voor geavanceerde en next-gen deeltjesversnellers Blootstelling aan ultrafijne aerosoldeeltjes in huizen hangt vooral af van mensen zelf
Blootstelling aan ultrafijne aerosoldeeltjes in huizen hangt vooral af van mensen zelf Waarom wordt de maan licht van de zon?
Waarom wordt de maan licht van de zon?  Vorming van stalagmieten in een grot?
Vorming van stalagmieten in een grot?  Stormwaterbankieren kan Texas helpen overstromingen en droogtes te beheersen
Stormwaterbankieren kan Texas helpen overstromingen en droogtes te beheersen Hoogte is belangrijk als het gaat om klimaatverandering, ontbossing en overleving van soorten
Hoogte is belangrijk als het gaat om klimaatverandering, ontbossing en overleving van soorten Nieuwe modellen onthullen innerlijke complexiteit van Saturnusmaan
Nieuwe modellen onthullen innerlijke complexiteit van Saturnusmaan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

