
Wetenschap
Wat doen de atomen tijdens een reactie die aantoont dat ze het behoud van de massa gehoorzamen?
* atomen worden niet gemaakt of vernietigd: Het fundamentele principe van het behoud van massa -toestanden dat materie niet kan worden gecreëerd of vernietigd in gewone chemische en fysische veranderingen. Dit betekent dat het totale aantal atomen van elk element aan de reactantzijde (de uitgangsmaterialen) gelijk moet zijn aan het totale aantal atomen van elk element aan de productzijde (de gevormde stoffen).
* herschikking, niet verdwijnen: Tijdens een chemische reactie gaan atomen niet verloren of gewonnen. In plaats daarvan herschikken ze eenvoudigweg om nieuwe moleculen of verbindingen te vormen. De atomen zelf blijven ongewijzigd.
* Balancing chemische vergelijkingen: We gebruiken evenwichtige chemische vergelijkingen om dit principe weer te geven. De coëfficiënten voor elke chemische formule geven het aantal moleculen of mol van elke betrokken stof aan. Door de vergelijking in evenwicht te brengen, zorgen we ervoor dat hetzelfde aantal atomen van elk element aanwezig is aan beide zijden van de vergelijking.
Voorbeeld:
Overweeg de verbranding van methaan (CH₄):
ch₄ + 2o₂ → co₂ + 2h₂o
* reactanten: 1 koolstof (c), 4 waterstof (H) en 4 zuurstof (O) atomen.
* Producten: 1 koolstof (c), 4 waterstof (H) en 4 zuurstof (O) atomen.
De atomen worden eenvoudig herschikt, waarbij de koolstof- en waterstofatomen van methaan combineren met zuurstofatomen uit de lucht om koolstofdioxide en water te vormen. Het totale aantal van elk type atoom blijft hetzelfde, wat het behoud van massa aantoont.
 Driedimensionale weergave van katalysatoren in actie
Driedimensionale weergave van katalysatoren in actie Vergeleken met de snelheid van een anorganische reactie is organisch meestal?
Vergeleken met de snelheid van een anorganische reactie is organisch meestal?  Wat veroorzaakt het verval van oplaadbare batterijen? Hangt ervan af hoe vaak je het hebt opgeladen
Wat veroorzaakt het verval van oplaadbare batterijen? Hangt ervan af hoe vaak je het hebt opgeladen Hoeveel zuurstofatomen en koolstof heeft een molecuul of dioxide?
Hoeveel zuurstofatomen en koolstof heeft een molecuul of dioxide?  Kan ik deze chemicaliën mengen? Daar is een app voor!
Kan ik deze chemicaliën mengen? Daar is een app voor!
 Studie werpt twijfel op over opwarmingsimplicaties van bruine koolstofaërosol door bosbranden
Studie werpt twijfel op over opwarmingsimplicaties van bruine koolstofaërosol door bosbranden Brown Snakes of Georgia
Brown Snakes of Georgia  Rapport beschuldigt Chinese bedrijven van ozonafbrekend gas
Rapport beschuldigt Chinese bedrijven van ozonafbrekend gas 'Hoe ruiken oude boeken?' – Het behoud van geuren als belangrijk cultureel erfgoed
'Hoe ruiken oude boeken?' – Het behoud van geuren als belangrijk cultureel erfgoed  Machine learning toepassen in intelligent weeradvies
Machine learning toepassen in intelligent weeradvies
Hoofdlijnen
- Wat zijn blaasjes parasieten?
- Waarom kan een breuk in de hoofdstam van de plant ervoor zorgen dat het sterft?
- Hoe zijn de twee zijden van celmembraan anders?
- Discovery onthult hoe planten cellulose maken voor kracht en groei
- Hoe verschillen algen van andere planten?
- Welk deel van de wetenschappelijke methode is een vraag?
- Louis Pasteur: Biografie, uitvindingen, experimenten en feiten
- Hoe transcriptie epigenetische silencing oplevert
- Waar staat de afkorting pH voor?
- Nieuw keramisch materiaal kan de kosten van piëzo-elektrische apparaten verlagen
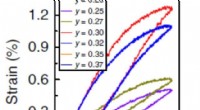
- Gebruik maken van de slagvastheid van 's werelds hardste beton voor rampenpreventie
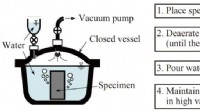
- Een nieuwe brandstofcel-elektrolyt

- Antioxidanten en kunststoffen kunnen worden gemaakt van bijproducten van het malen van tarwe

- lichtgewicht, slagvaste honingraatstructuren kunnen voelen wanneer ze beschadigd zijn
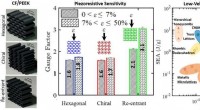
 Hoe het bestuderen van UFO's kan leiden tot nieuwe wetenschappelijke doorbraken
Hoe het bestuderen van UFO's kan leiden tot nieuwe wetenschappelijke doorbraken Wetenschappers verbeteren de analyse van röntgengegevens met kunstmatige intelligentie
Wetenschappers verbeteren de analyse van röntgengegevens met kunstmatige intelligentie Fossielen uit dit tijdperk bevatten eenvoudige waterorganismen zonder bewijs van leven op het land?
Fossielen uit dit tijdperk bevatten eenvoudige waterorganismen zonder bewijs van leven op het land?  Welke agenten van erosie vormen U-vormige valleien?
Welke agenten van erosie vormen U-vormige valleien?  Wat zijn hoeken van elevatie en depressie?
Wat zijn hoeken van elevatie en depressie?  Afstembare materialen maken de weg vrij voor geavanceerde optica
Afstembare materialen maken de weg vrij voor geavanceerde optica Gebroken record:maart is de 10e maand op rij en de heetste maand ooit, zeggen wetenschappers
Gebroken record:maart is de 10e maand op rij en de heetste maand ooit, zeggen wetenschappers  Voorkeur voor bemonstering kan het beeld van onrust als gevolg van de opwarming van de aarde vertekenen
Voorkeur voor bemonstering kan het beeld van onrust als gevolg van de opwarming van de aarde vertekenen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

