
Wetenschap
Het watermolecuul is polair, wat betekent dat elk uiteinde van het een elektrische lading heeft omdat dit karakteristieke water?
* waterstofbinding: Het positieve uiteinde van het ene watermolecuul (de waterstofatomen) wordt aangetrokken door het negatieve uiteinde van een ander watermolecuul (het zuurstofatoom). Deze attracties worden waterstofbruggen genoemd. Waterstofbindingen zijn afzonderlijk relatief zwak, maar gezamenlijk maken ze water zeer samenhangend. Dit is de reden waarom water een hoge oppervlaktespanning heeft, waardoor dingen als insecten erop kunnen lopen.
* Hoge specifieke warmte: Vanwege de waterstofbindingen heeft water veel energie nodig om zijn temperatuur te verhogen. Dit maakt water een uitstekende temperatuurregelaar, die helpt om het klimaat van de aarde te matigen en stabiele interne temperaturen in levende organismen te behouden.
* Universeel oplosmiddel: Door de polariteit van water kan het veel stoffen oplossen, waaronder zouten en suikers. Dit komt omdat de geladen uiteinden van watermoleculen geladen moleculen kunnen omringen en scheiden, waardoor het een essentieel oplosmiddel is voor chemische reacties in levende organismen.
* Dichtheid Anomalie: Water is minder dicht als een vaste stof (ijs) dan als een vloeistof. Dit komt omdat de waterstofbindingsmoleculen in een meer open, kristallijne structuur in ijs dwingen. Dit is de reden waarom Ice Float, wat belangrijke implicaties heeft voor het waterleven en het klimaat van de aarde.
Kortom, de polariteit van water is de reden waarom het zo'n unieke en vitale stof voor het leven is als we die kennen.
 Op polyoxometalaat gebaseerde coördinatiekaders voor de vorming van methaan bij de fotoreductie van koolstofdioxide
Op polyoxometalaat gebaseerde coördinatiekaders voor de vorming van methaan bij de fotoreductie van koolstofdioxide Polymeren die ziektekiemen snel en effectief doden, zullen helpen in de strijd tegen multiresistente microben
Polymeren die ziektekiemen snel en effectief doden, zullen helpen in de strijd tegen multiresistente microben Enzym ontdekt in de darm kan leiden tot nieuwe biomarker voor ziekten
Enzym ontdekt in de darm kan leiden tot nieuwe biomarker voor ziekten Wat is het verschil tussen de twee isotopen van koper?
Wat is het verschil tussen de twee isotopen van koper?  Hoe groot is het acetonmolecuul?
Hoe groot is het acetonmolecuul?
 Lasers brengen een revolutie teweeg in het in kaart brengen van bossen
Lasers brengen een revolutie teweeg in het in kaart brengen van bossen Nieuwe benchmarkingtool zal de aquacultuurprestaties in de Middellandse Zee meten
Nieuwe benchmarkingtool zal de aquacultuurprestaties in de Middellandse Zee meten Waarom was de wetenschap belangrijk voor de vroege beschaving?
Waarom was de wetenschap belangrijk voor de vroege beschaving?  Bill Nye zegt dat de VS faalt in een nationale test van wetenschappelijke geletterdheid
Bill Nye zegt dat de VS faalt in een nationale test van wetenschappelijke geletterdheid  Studie onthult dynamiek van oppervlaktewaterlichamen met een ruimtelijke resolutie van 30 meter
Studie onthult dynamiek van oppervlaktewaterlichamen met een ruimtelijke resolutie van 30 meter
Hoofdlijnen
- Weefsel dat verantwoordelijk is voor translocatie van voedsel in planten?
- Waarom zijn archaea en bacteriën anders dan andere koninkrijken?
- Lijst met toepassingen van elektroforese
- Mensen en gorilla's hebben één ander aminozuur in hun hemoglobine -sequentie. Wat zegt dit over de evolutie van deze twee soorten?
- Mysteriegen rijpt het skelet van de cel
- Wat is de functie van een vocaole in dierencel?
- Wat is de betekenis van het afleiden van het wetenschapsproces?
- Op het hek:nieuw onderzoek maakt gebruik van de expertise van ranchers over het leven met carnivoren
- Kan de ademhaling van de cel optreden in het organisme op een temperatuur boven T65 deg c - Reden geven?
- Vloeibare zwavel verandert van vorm en wordt kritisch onder druk

- Onderzoekers maken op parelmoer geïnspireerde superoleofobe onderwaterfilms
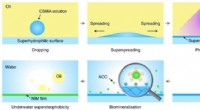
- Het testen van de mogelijkheid om nikkelhoudende katalysatoren te gebruiken om multi-koolstofproducten te produceren
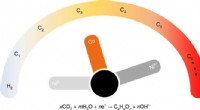
- Een natuurlijk geïnspireerde, herbruikbaar systeem dat water zuivert en zichzelf opbouwt

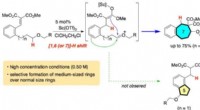
- Onderzoekers ontwikkelen methode om het skelet van veelvoorkomende chemicaliën te verbeteren
 Wil je natuurlijke voedingskleurstof? Amarant levert volgens onderzoek
Wil je natuurlijke voedingskleurstof? Amarant levert volgens onderzoek  Wat is de oorsprong van minerale hulpbronnen?
Wat is de oorsprong van minerale hulpbronnen?  Welke term betekent een witte bloedcel die binnenvallende cellen omringt en doodt?
Welke term betekent een witte bloedcel die binnenvallende cellen omringt en doodt?  Hoe geothermisch systeem classificeren?
Hoe geothermisch systeem classificeren?  Hoe Discrete Math te leren
Hoe Discrete Math te leren  Wat is Mars -grootte en distanc van de zonnevales?
Wat is Mars -grootte en distanc van de zonnevales?  De geest is afgeleid:technologie strijdt om onze aandacht
De geest is afgeleid:technologie strijdt om onze aandacht Schoolprojecten over natuurlijke hulpbronnen
Schoolprojecten over natuurlijke hulpbronnen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

