
Wetenschap
Welke chemische binding slaat de meeste energie op?
Dit is waarom:
* bindingssterkte: Drievoudige bindingen omvatten het delen van zes elektronen tussen twee koolstofatomen. Dit creëert een zeer sterke aantrekkingskracht tussen de atomen, waarvoor veel energie nodig is om de binding te verbreken.
* Energieopslag: Hoe hoger de bindingssterkte, hoe meer energie wordt opgeslagen binnen de binding.
Terwijl andere bindingen zoals C =O (carbonyl) of C-H (koolstofhydrogen) ook belangrijk zijn in energieopslag, bevat de drievoudige binding in koolstof-koolstofbindingen de meeste energie per binding.
Voorbeeld: De energie die is opgeslagen in een C≡C-binding is aanzienlijk hoger dan die van een C =C (dubbele binding) of C-C (enkele binding). Dit is de reden waarom moleculen die drievoudige bindingen bevatten, zoals acetyleen (C2H2), worden gebruikt als brandstoffen.
 Hoe Molaire massa te berekenen
Hoe Molaire massa te berekenen  Doorbraak in elektrolyse kan het waterstofvraagstuk oplossen
Doorbraak in elektrolyse kan het waterstofvraagstuk oplossen Wat zijn enkele bewijzen van een chemische verandering?
Wat zijn enkele bewijzen van een chemische verandering?  Onderzoekers onderzoeken hoe de drijvende krachten achter de klimaatverandering de methaan- en lachgascycli in de oceaan hervormen
Onderzoekers onderzoeken hoe de drijvende krachten achter de klimaatverandering de methaan- en lachgascycli in de oceaan hervormen  Diepeutectische oplosmiddelen vervangen vervuilende industriële oplosmiddelen
Diepeutectische oplosmiddelen vervangen vervuilende industriële oplosmiddelen
 Altruïsme:genetische of culturele evolutie?
Altruïsme:genetische of culturele evolutie?  Aardwormkenmerken
Aardwormkenmerken Eerlijkere financiering zou het netto nulpunt voor Afrika met een decennium kunnen versnellen
Eerlijkere financiering zou het netto nulpunt voor Afrika met een decennium kunnen versnellen Gevaarlijk brouwsel:de hitte van de oceaan en de combinatie van La Nina betekenen waarschijnlijk meer Atlantische orkanen deze zomer
Gevaarlijk brouwsel:de hitte van de oceaan en de combinatie van La Nina betekenen waarschijnlijk meer Atlantische orkanen deze zomer  Viskooifarming
Viskooifarming
Hoofdlijnen
- Welke sierplanten presteren het beste voor bestuivers?
- Waarom het bestrijden van invasieve soorten een van de beste manieren is om je voor te bereiden op klimaatverandering
- Tijgers klampen zich vast aan overleving in steeds meer gefragmenteerde bossen op Sumatras
- De laboratoriumprocedure voor het kopiëren van geselecteerde segmenten van DNA is?
- Waarom heb je ervoor gekozen om biologie te studeren?
- Welke morfologische eigenschap maakt geen deel uit van het verdedigingsmechanisme in planten?
- Waarom repliceert wetenschapper een ander experiment?
- Fruitvliegjes laten zien hoe salmonella aan de immuunafweer ontsnapt
- Hoe noem je een membraan waarmee bepaalde stoffen er alleen doorheen kunnen gaan?
- De nieuwe alchemie in koolstofneutraliteit:water omzetten in ammoniak met alleen hernieuwbare energie
- Geleidende biopolymeren met gerecyclede bijproducten van de voedingsindustrie

- Nieuw 3D-printproces biedt nieuwe ontwerpopties voor energieopslag

- Nieuw nano-apparaat zou zonne-energie kunnen gebruiken om waterstof te produceren
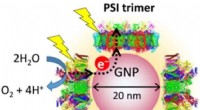
- Vervuilers, ziekteverwekkers kunnen samenwerken om ons ziek te maken

 Waarom worden straalmotoren op grote hoogte gevlogen?
Waarom worden straalmotoren op grote hoogte gevlogen?  Heeft u geen energie meer?
Heeft u geen energie meer?  Oplossing gevonden voor het grote pannenkoekmysterie van de kosmologie?
Oplossing gevonden voor het grote pannenkoekmysterie van de kosmologie?  Een vergelijking converteren naar Vertex-formulier
Een vergelijking converteren naar Vertex-formulier  Hoe helpt de omgeving ons?
Hoe helpt de omgeving ons?  Van de plaats delict naar de rechtszaal - de reis van een DNA-monster
Van de plaats delict naar de rechtszaal - de reis van een DNA-monster De juiste bodembedekker kiezen om de bodem te beschermen
De juiste bodembedekker kiezen om de bodem te beschermen Welke cel in floëemweefsel heeft een kern?
Welke cel in floëemweefsel heeft een kern?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

