
Wetenschap
Lost vast gas of vloeistof opgeloste vaste omstandigheden het beste op onder hoge temperatuuromstandigheden op?
Dit is waarom:
* Verhoogde kinetische energie: Naarmate de temperatuur toeneemt, krijgen de moleculen van zowel de opgeloste stof als oplosmiddel kinetische energie. Dit betekent dat ze sneller bewegen en vaker botsen.
* Breek intermoleculaire krachten: De verhoogde kinetische energie helpt de intermoleculaire krachten te overwinnen die de opgeloste deeltjes bij elkaar houden, waardoor ze uit elkaar kunnen breken en oplossen.
* Verbeterde solvatie: Hogere temperaturen verhogen ook het vermogen van het oplosmiddel om de opgeloste deeltjes op te lossen (te omringen), waardoor het oplossingsproces verder wordt geholpen.
Uitzonderingen:
* gassen: Gassen lossen op * minder * goed bij hogere temperaturen. Dit komt omdat de verhoogde kinetische energie ervoor zorgt dat de gasmoleculen gemakkelijker uit de oplossing kunnen ontsnappen.
* vloeistoffen: Het effect van temperatuur op oplosbaarheid opgeloste opgeloste stof is minder voorspelbaar en hangt af van de specifieke vloeistof. Sommige vloeistoffen worden meer oplosbaar met toenemende temperatuur, terwijl anderen minder oplosbaar worden.
Samenvattend:
* vaste stoffen: Over het algemeen meer oplosbaar bij hogere temperaturen.
* gassen: Over het algemeen minder oplosbaar bij hogere temperaturen.
* vloeistoffen: Variabele, afhankelijk van de specifieke vloeistof.
 grillige winden, droge omstandigheden voeden dodelijke branden in Californië
grillige winden, droge omstandigheden voeden dodelijke branden in Californië Intensere en frequentere onweersbuien in verband met wereldwijde klimaatvariabiliteit
Intensere en frequentere onweersbuien in verband met wereldwijde klimaatvariabiliteit Wat doet een wijnstok?
Wat doet een wijnstok?  Droogte, grondwaterverlies doet Californië in schrikbarend tempo zinken
Droogte, grondwaterverlies doet Californië in schrikbarend tempo zinken Dubbel zien:tropische cycloon Kenanga even sterk als andere storm
Dubbel zien:tropische cycloon Kenanga even sterk als andere storm
Hoofdlijnen
- Schimmeluitbraak bedreigt driekleurige vleermuis met uitsterven
- Stille soorten worden met uitsterven bedreigd:onderzoek wijst op vooringenomenheid in onderzoek naar natuurbehoud
- Waar komt pollen het vrouwelijke deel van een plant binnen?
- Plantensporen worden rechtstreeks geproduceerd door?
- Wat zijn de kenmerken van een tuinwt?
- Welke 3 dingen laten celdeling levende organismen toe?
- Welke moleculen je op je telefoon achterlaat, onthullen iets over je levensstijl
- Pandoravirus:Het smeltende noordpoolgebied laat oude ziektekiemen vrij – hoe bezorgd moeten we ons maken?
- Kunnen schimmels de modewereld redden?
- Plantaardige eiwitten vervangen op aardolie gebaseerde grondstoffen

- Vuurvliegjes werpen licht op de functie van mitochondriën
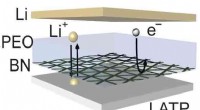
- Nieuwe techniek produceert lithiumbatterijen met een langere levensduur
- Chemici vereenvoudigen de synthese van antitumorverbindingen
- Bedrieglijk eenvoudig proces kan de recycling van kunststoffen stimuleren

 Welke massa waterstofchloride is nodig om te reageren met 100 g roest?
Welke massa waterstofchloride is nodig om te reageren met 100 g roest?  Hoe het in realtime meten van emissies steden kan helpen een netto nulpunt te bereiken
Hoe het in realtime meten van emissies steden kan helpen een netto nulpunt te bereiken  NASA-ruimtevaartuig begint 2-jarige reis naar huis met asteroïde puin
NASA-ruimtevaartuig begint 2-jarige reis naar huis met asteroïde puin Supercomputing toekomstige stijging van windenergie
Supercomputing toekomstige stijging van windenergie Hoe zou u iemand in Port Howe de locatie van Diablo -termen absolute locatie vertellen?
Hoe zou u iemand in Port Howe de locatie van Diablo -termen absolute locatie vertellen?  Hoe het trommelvlies van een sprinkhaan tot kleine microfoons kan leiden
Hoe het trommelvlies van een sprinkhaan tot kleine microfoons kan leiden  Welk type als energieoverdracht als je een wortel eet?
Welk type als energieoverdracht als je een wortel eet?  Hoe is vloeistof gerelateerd aan een amorfe vaste stof?
Hoe is vloeistof gerelateerd aan een amorfe vaste stof?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

