
Wetenschap
Kunnen edelgassen zich verbinden met elk atoom?
Dit is waarom:
* Volledige valentieschalen: Nobele gassen hebben een volledige buitenste schaal van elektronen, waardoor ze extreem stabiel en niet -reactief zijn. Daarom worden ze "nobele" gassen genoemd.
* Beperkte binding: Ze kunnen alleen binden onder zeer specifieke en extreme omstandigheden, zoals:
* Hoge druk: Onder hoge druk kunnen ze verbindingen vormen zoals XEPTF6 (Xenon hexafluoroplatinaat) en KRF2 (Krypton difluoride).
* plasma: In een plasma -toestand kunnen ze ionen vormen en deelnemen aan reacties.
* excitatie: Wanneer ze opgewonden zijn met energie, kunnen ze tijdelijk banden vormen.
* Andere elementen: De meeste elementen vormen gemakkelijk bindingen vanwege hun onvolledige buitenschalen, waardoor ze reactiever zijn dan edelgassen.
Hoewel het mogelijk is dat edelgassen onder specifieke omstandigheden binden, binden ze daarom niet gemakkelijk bij elk atoom. Hun stabiliteit en volledige elektronenschalen doen ze minder snel deelnemen aan chemische reacties in vergelijking met andere elementen.
 Is de watertemperatuur van belang voor het verwijderen van vlekken door wasmiddelen?
Is de watertemperatuur van belang voor het verwijderen van vlekken door wasmiddelen?  Meest bijtende zuren en basen bekend bij de mensheid
Meest bijtende zuren en basen bekend bij de mensheid
De corrosiviteit van een zuur of base verwijst naar de mate waarin het oppervlak bij contact, met name levend weefsel, ernstig wordt beschadigd. Sterke zuren en basen zoals fluorwaterstofzuur en
 Experimenten op afstand tonen de waarde van wereldwijde verbindingen tijdens de pandemie
Experimenten op afstand tonen de waarde van wereldwijde verbindingen tijdens de pandemie Chemicaliën kunnen hun identiteit veranderen, dankzij de vloeistoffen waar ze zich bevinden
Chemicaliën kunnen hun identiteit veranderen, dankzij de vloeistoffen waar ze zich bevinden Welke verbinding bevat geen koolstof en waterstof samen?
Welke verbinding bevat geen koolstof en waterstof samen?
 De drie cycli van het ecosysteem
De drie cycli van het ecosysteem  Welke planten leven op Antelope Island?
Welke planten leven op Antelope Island?  Milieubewegingen, big ag verenigt u voor Amazon in Brazilië
Milieubewegingen, big ag verenigt u voor Amazon in Brazilië Wetenschappers constateren dat er minder neerslag valt in de zomer op het Tibetaanse plateau na grote tropische vulkaanuitbarstingen
Wetenschappers constateren dat er minder neerslag valt in de zomer op het Tibetaanse plateau na grote tropische vulkaanuitbarstingen Seismische stresskaartprofielen veroorzaakten aardbevingsrisico voor West-Texas, New Mexico
Seismische stresskaartprofielen veroorzaakten aardbevingsrisico voor West-Texas, New Mexico
Hoofdlijnen
- Wat is een van de beschermende structuren in een cel?
- Een nieuwe aanpak om te bepalen hoe kankerverwekkende bacteriën hun doelwitten vinden
- Zou het nauwkeurig zijn om te zeggen dat alle meercellige organismen hetzelfde type en aantal uitleg hebben?
- Waarom is nagelriem een nuttige aanpassing in planten maar geen algen?
- Waarom de stinkende durian echt 'koning van alle vruchten' is
- Staat, FBI onderzoekt ziekte die ziek is, dode honden
- Welk hormoon is verantwoordelijk voor dwergachtige en gigantisme?
- Over hoeveel verschillende soorten organismen hebben wetenschappers tot nu toe ontdekt?
- Wat de levendige pigmenten van vogelveren ons kunnen leren over hoe evolutie werkt
- Ingenieursreactor zet gas direct om in azijnzuur

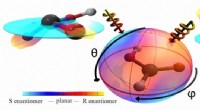
- Dupliceren of spiegelen? Laserlicht bepaalt chiraliteit van moleculen
- Beeldvorming van opeenvolgende potentiaalverdelingsveranderingen in elektroden tijdens laden/ontladen

- Onderzoekers laten zien hoe mengsels van biomoleculen communiceren, interageren en zich aanpassen aan hun omgeving

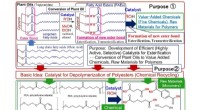
- Een hoogwaardige katalysator die polyester oplost en chemische recycling realiseert
 Licht op waarom plastic geel wordt
Licht op waarom plastic geel wordt Mysterie van de Bazel-papyrus opgelost
Mysterie van de Bazel-papyrus opgelost Wat zijn de kenmerken van niet-levende dingen?
Wat zijn de kenmerken van niet-levende dingen?  Waarom is de impotantie van de ozonlaag voor klimaatverandering?
Waarom is de impotantie van de ozonlaag voor klimaatverandering?  Wetenschap zonder zwaartekracht in het internationale ruimtestation
Wetenschap zonder zwaartekracht in het internationale ruimtestation Wanneer begonnen mensen zonne -energie te gebruiken?
Wanneer begonnen mensen zonne -energie te gebruiken?  TESS onthult een onwaarschijnlijke planeet
TESS onthult een onwaarschijnlijke planeet Sociaal-economische deprivatie verandert genetische invloed op hoger onderwijs
Sociaal-economische deprivatie verandert genetische invloed op hoger onderwijs
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

